Zusammenfassung
Facharzt für Frauenheilkunde
Seit Juni 2002 Leiter der Abteilung „Koordination der Lehre“ an der Universitätsklinik für Frauenheilkunde der Medizinischen Universität Wien (AKH)
Wissenschaftlich beschäftigt sich Prof. Dadak vornehmlich mit gynäkologischer Onkologie (Krebserkrankungen) und mit Erkrankungen der Brust, aber auch die Prae- und Perinatal Medizin (Erkrankungen und Komplikationen in der Schwangerschaft und rund um die Geburt) ist wichtiger Bestandteil seiner ärztlichen Tätigkeit.
Leseprobe
Inhaltsverzeichnis
- Cover
- Half Title
- Titel Seite
- Impressum
- Vorwort zur 5. Auflage
- Inhaltsverzeichnis
- Gynäkologie
- Kindergynäkologie, pathologische Blutungen
- Beckenschmerz
- Gynäkologische Pathologie I
- Gynäkologische Pathologie II
- Gynäkologische Pathologie III
- Maligne Ovarialtumore
- Erkrankungen des Corpus uteri
- Erkrankungen der Vulva und Vagina
- Erkrankungen der Cervix uteri
- Abklärung und Therapie der weiblichen Inkontinenz und Deszensus
- Tubaria
- Abklärung und Therapie weiblicher Infektionen
- Uterurmyome
- Sexualprobleme bei onkologischen Patientinnen
- Brusterkrankungen
- Benigne Brustdrüsenerkrankungen
- Maligne Brustdrüsenerkrankungen
- Geburtshilfe
- Hypertensive Schwangerschaftserkrankungen
- Die regelwidrige Geburt
- Erkrankungen in der Schwangerschaft
- Geburtshilfliche Notfälle
- Pathologie der Nachgeburtsperiode
- Kardiotokogramm – CTG
- Diabetes in der Schwangerschaft
- Mehrlingsschwangerschaft
- Rhesus-Inkompatibilität
- Management von plazentationsbedingter Wachstumsretardierung
- Pathologie der Plazenta und der Nabelschnur
- Terminüberschreitung und Geburtseinleitung
- Schwangerschaftsabbruch
- Gynäkologische Endokrinologie und Sterilitätsbehandlung
- Pathologien des Menstruationszyklus
- Polyzystisches Ovar Syndrom und andere endokrine Störungen: Praktisches Vorgehen
- Endometriose
- AutorInnenverzeichnis
- Rückseite
Gynäkologie
Kindergynäkologie, pathologische Blutungen
Daniela Dörfler
Übersicht
Dieses Kapitel beschäftigt sich mit den praktischen Aspekten, Differentialdiagnosen und therapeutischen Ansätzen zu den Themen
• abnorme Vaginalblutungen in der Kindheit sowie Grundlagen und häufige Diagnosen in der Kinder- und Jugendgynäkologie
• abnorme Vaginalblutungen in der Adoleszenz und reproduktiven Phase
• abnorme Vaginalblutungen in der Postmenopause
Kinder- und Jugendgynäkologie Schwerpunkt: Pathologische Blutungen in der Kindheit
Eine gynäkologische Untersuchung in der Kindheit gestaltet sich bei strenger Indikationsstellung in folgende Abschnitte: Es wird eine ausführliche Anamnese je nach Situation mit oder ohne Bezugsperson durchgeführt. Daran schließt eine Inspektion der Mammae an, die nach den Tannerstadien B1–B5 in ihrer Entwicklung beurteilt werden. Störungen in der Brustentwicklung wären eine Polythelie, Hypoplasie, Rüsselbrust oder Asymmetrie. Die gynäkologische Untersuchung kann auf einer Liege oder am Schoß der Mutter/des Vaters oder auch am Untersuchungsstuhl in Froschschenkelposition durchgeführt werden. Die Stadien der Schambehaarung werden nach den Tannerstadien P1–P5 eingeteilt. Mittels Traktionsmethode erfolgt eine Inspektion der Vulva, des Vestibulums und des Hymenalsaumes unter Separation und Traktion am Gluteus maximus. Eine rektale Untersuchung und/oder Vaginoskopie wird nur bei Verdacht auf Raumforderungen, Fremdkörpern, Tumore, atypischen genitalen Blutungen, rezidivierenden genitalen Infektionen, Entwicklungsstörungen, Fehlbildungen oder angeborenen Störungen durchgeführt. Für die Ultraschalluntersuchung wird hauptsächlich ein transabdomineller (volle Harnblase), selten ein transrektaler oder transvaginaler Zugang gewählt. Bei speziellen Fragestellungen wie beispielsweise der Abklärung von Fehlbildungen oder Beurteilung von sexuellem Missbrauch bei massiver Traumatisierung des Kindes wird eine Narkoseuntersuchung indiziert.
Als Differentialdiagnosen zu den Ursachen von vaginalen Blutungen im Kindes- und Jugendalter sind
• Fremdkörper
• Trauma, sexuelle Misshandlung
• Vulvovaginitis
• Lichen sclerosus
• Pubertas praecox
• Ovarialtumore
• exogene Östrogene
• DD: Blutungen im Bereich des Harntraktes/Gastrointestinaltraktes anzuführen.
Vulvovaginitis
Ursachen, Abklärung und Behandlung der Vulvovaginitis als häufigste Ursache von vaginalen Blutungen im Kindesalter vor der Menarche.
Die Entstehung der Vulvitis bzw. Vulvovaginitis wird durch fehlenden Östrogeneinfluss, eine geringe vaginale Schutzflora und die physiologische hormonelle Ruheperiode getriggert. In der Anamnese sollte als Ursache eine Adipositas, gastrointestinale Infekte, ein Diabetes mellitus, eine HI-Virus-Infektion, übertriebene oder mangelnde Intimhygiene, falsche Wischrichtung auf der Toilette („von hinten nach vorn“) und entsprechende qualitative Unterwäsche erhoben bzw. angesprochen werden. Hierzu eignet sich ein Informationsblatt, das den Eltern bei der Abklärung mitgegeben werden sollte. In Spezialambulanzen erscheint eine weiterführende Untersuchung bei Rezidiverkrankungen mit bakteriellen Abstrichen bzw. bei therapieresistenten Vulvovaginitiden einem Fremdkörperausschluss mittels Vaginoskops indiziert.
Als therapeutische Ansätze sind eine Verbesserung der Intimhygiene, Lokaltherapien mit milden Sitzbädern mit z. B. Eichenrinde oder Kamille und eine orale Antibiose entsprechend des Kulturbefundes nach dem Hygieneabstrich bei rezidivierenden Infektionen empfohlen.
Lichen sclerosus
Definition: Aktiver, chronischer, metabolischer Prozess des Vulvaepithels, der zu einer atrophischen Umwandlung der Vulva führt.
Die Ätiologie ist unbekannt. Eine genetische Prädisposition wird vermutet. Es handelt sich um ein häufiges Krankheitsbild in der Menopause. Die Symptomtrias setzt sich aus Pruritus vulvae, Schmerzen im Genitalbereich und lokalen Einblutungen zusammen. Der Lokalbefund zeigt einen weißlichen, perlmuttartigen Glanz der Labien mit Verstreichen der Interlabialfalte. Als Akuttherapie wird lokales Kortikosteroid für vier Wochen und im Intervall fetthaltige Pflegecreme empfohlen. Die juvenile Lichenerkrankung heilt meist in der Pubertät aus. Ein leicht erhöhtes Risiko für ein Plattenepithelkarzinom der Vulva wurde erhoben.
Pubertas praecox
Definition: Auftreten von Pubertätszeichen vor dem 7. Lebensjahr, bzw. Menarche vor dem 8. Lebensjahr.
Man unterscheidet 2 Formen: Eine Pubertas praecoxvera, als deren Ursache werden idiopathische, zerebral-organische Ursachen wie z. B. Tumoren im Bereich des Hypothalamus, postentzündliche Schäden oder Trauma sowie periphere Ursachen wie z. B. Teratome oder gonadotropin-sezernierende Tumoren angenommen. Bei der zweiten Form, die als Pseudopubertas praecox bezeichnet wird, wären ursächlich östrogenproduzierende Ovarialtumore, Nebennierenrindentumore oder eine exogene Östrogenzufuhr zu erheben. Eine Diagnostik zur Abklärung der Pubertas praecox setzt sich aus einer klinischen Untersuchung, einer Sonographie der Ovarien, des Uterus, und der Nebennieren, einer Vaginalzytologie, die den Reifegrad der Epithelien beschreibt, einer endokrinologischen Untersuchung mittels Hormonstatus, der die Werte LH, FSH, Prolaktin, TSH, ß-hCG, GnRH, DHEA-S, 17-ß-Östradiol enthalten sollte und bei Verdacht auf Tumoren oder Hypophysenadenomen einem Schädel-MRI zusammen. Therapieansätze sind kausal (z. B. operativ) bzw. konservativ mit GnRH-Agonisten (Leuprorelin, Enantone®).
Trauma und sexuelle Misshandlung
Die Abklärung und Spurensicherung bei Verdacht erfolgt nach einer definierten Checkliste laut den Leitlinien zur Gewaltabklärung. Folgende Schritte werden empfohlen: Eine Anamnese mit offener Fragestellung mit einer körperlichen Untersuchung durch erfahrene/n Fachärztin/-arzt in entsprechendem intimen Rahmen. Die möglichen Befunde sind Erytheme, Ödeme, Schürfungen, Blutungen, Hymenaleinrisse und/oder perianale Einrisse und werden nach der Klassifikation nach Adams für präpubertäre Mädchen nach 5 Schweregraden eingeteilt. Eine Ballonkatheteruntersuchung kann die Hymenbeurteilung erleichtern. Ein Harnkatheter wird dabei in die Scheide eingebracht und hinter dem Hymen mit etwas Flüssigkeit gecufft und an das Hymen verlagert. Es sollte nach Geschlechtskrankheiten wie z. B. Chlamydien, Trichomoniasis, Gonorrhoe oder HPV gescreent werden. Ein Nachweis von Spermien ist maximal 72 Stunden nach vaginalem Übergriff erhebbar. Orale Abstriche zeigen 12 Stunden und anale Abstriche 24 Stunden Spermiennachweise bzw. DNA Spuren. Eine weitere psychologische Unterstützung oder akute Exploration in einer forensischen Ambulanz sind wichtige interdisziplinäre weiterführende Schritte. Bei Mädchen nach der Menarche empfiehlt sich ein Schwangerschaftstest und das niederschwellige Anbieten einer Notfall-Kontrazeption. Eine HIV-Postexpositions-Prophylaxe sollte in den ersten 24 Stunden nach Übergriff durchgeführt werden. Bei schwerer Körperverletzung ist eine Anzeige indiziert. In den meisten Fällen wird im Sinne des Kindeswohles eine Gefährdungsmeldung an das Amt für Jugend und Familie und eine Meldung an die hauseigene Kinderschutzgruppe als erste Schritte empfohlen. Im Zweifelsfall wird das Kind zur weiteren interdisziplinären Abklärung und Dokumentation stationär aufgenommen.
Weitere Themengebiete in der Kinder- und Jugendgynäkologie
Ein häufiges Thema der Mädchensprechstunde stellt die Frage nach der körperlichen Normalität dar. Die Jugendlichen wollen wissen, ob sie sich normal entwickeln und wann welche Entwicklungsschritte zu erwarten sind.
Tab. 1
| Knaben | Mädchen | |
| Brustentwicklung | 11,2 | 11,2 |
| Hodenvergrößerung | 11,6 | |
| Schamhaarentwicklung | 13,4 | 11,7 |
| maximales Wachstum | 14,1 | 12,1 |
| Menarche | 13,5 | |
| Schamhaar voll ausgebildet | 15,2 | 14,4 |
| Brust voll ausgebildet | 15,3 |
Ein häufig diskutierter Befund ist auch die Labiengröße. Definitionsgemäß werden die Labiaminora von den Labiamajora überdeckt. Die Größe der Labien kann 0–6 cm betragen. In den meisten Fällen findet sich die Größe der Labien zwischen 0–2 cm. Eine Labienhypertrophie und eine daraus resultierende Labienkorrektur sind nur bei ausgeprägter Symptomatik indiziert.
Das Jungfernhäutchen oder Hymen zeigt in seiner Ausprägung eine hohe Variabilität. Man unterscheidet ein Hymen microperforatus, cribriforme, semilunare, Hymenalsepten und die Hymenalatresie, die nach der Menarche symptomatisch wird und Hymenalpolypen, die beobachtet werden dürfen, wenn sie klein und asymptomatisch am Hymenalrand imponieren. Ein Hymen imperforatum wird sternförmig eröffnet. Entscheidend ist die Beachtung der großen Variationsbreite bei der forensischen Beurteilung des Hymens.
Die Labiensynechie ist ein vor der Menarche häufig präsentiertes Krankheitsbild, dem rezidivierende Vulvitiden vorangehen können. Die Therapie ist eine lokale mit topischem Östrogen. Rezidive sind in der hormonellen Ruheperiode häufig zu beobachten. Eine manuelle Öffnung nach Vorbehandlung ist zielführend. Pflegesalben im Intervall angezeigt, um ein Rezidiv zu verhindern. Ungestörtes Urinieren sollte anamnestisch abgefragt werden.
Eine primäre Amenorrhoe ist definiert als Ausbleiben der Menarche bis zum vollendeten 15. Lebensjahr. Mögliche Ursachen sind in 50 % der Fälle auf der hypothalamisch-hypophysären Ebene bei z. B. Essstörungen wie Anorexie, einer Hypopyseninsuffizienz, bei Hypophysenadenomen oder nach Traumata zu finden. In 12–15 % ist eine Ovarialinsuffizienz bei genetischen Erkrankungen wie z. B. dem Turner-Syndrom (X0) oder nach einer Chemotherapie die Ursache für eine primäre Amenorrhoe. Ein anatomischer Defekt wie z. B. eine Hymenalatresie oder ein Mayer-Rokitansky-Küster-Hauser Syndrom (MRKH) kann in 10 % zu Grunde liegen. Eine metabolisch-endokrine Amenorrhoe (13 %) ist z. B. bei Hypothyreose oder Adipositas die Ursache des Ausbleibens der Menarche. In 7 % der Fälle wird eine Hyperandrogenämie bei Krankheitsbildern wie z. B. dem PCO oder dem AGS als Ursache für die primäre Amenorrhoe erhoben.
Beim MRK steht nach genetischer Abklärung und einem MRT des Beckens eine Bildung einer Neovagina bei den größeren Mädchen am Plan. Hierzu sind mehrere operative Ansätze möglich. Im Rahmen einer diagnostischen Laparoskopie wird eine Operation nach Vecchieti durchgeführt. Kinderchirurginnen und -chirurgen bevorzugen die Bildung einer Sigmascheide. An unserer Klinik wird die Methode Wharton-Sheares-George bevorzugt, die auf einer Dehnung der Müller´schen Gänge – mit einer intraoperativen Phantomeinlage – basiert. Bei Rezidiven mit Verklebung der Neovagina kann eine Spalthautvagina indiziert sein.
Bei der sekundären Amenorrhoe finden sich:
• anovulatorische Zyklen
• persistierende Ovarialzysten
• hypothalamisch-hypohysäre Ursachen
• Hyperprolaktinämie
• ovarielle Ursachen
• extragenital endokrine Ursachen
• sekundär uterine Erkrankungen als Auslöser, sodass die Regelblutung für einen längeren Zeitpunkt sistiert
Durch Untergewicht (BMI < 19), das durch Essstörungen wie Anorexie, Bulimie, eine Situationsamenorrhoe hervorgerufen wird, kommt es auf der hypothalamischhypophysären Ebene zum Ausbleiben der Regelblutung, aber auch Stress, bzw. Veränderung des Tag-Nacht-Rhythmus, reaktiv auf psychogene Ursachen und Medikamente wie z. B. Psychopharmaka oder Antihypertensiva, die den Zyklus beeinflussen, tragen dazu bei.
Ovarielle Ursachen der sekundären Amenorrhoe wären das Syndrom der polyzystischen Ovarien (PCOS, Stein-Leventhal-Sydrom) und ein zumeist iatrogen verschuldetes Klimakterium praecox.
Extragenital auf der endokrinen Ebene wäre ein Adrenogenitales Syndrom (AGS) und Schilddrüsenerkrankungen auszuschließen.
Auf der uterinen Ebene wäre ein Asherman-Syndrom (Zerstörung der Basalschicht des Endometriums bei Abrasio) zu vermeiden.
Dysmenorrhoe und prämenstruelles Syndrom (PMS)
Man unterscheidet eine primäre Dysmenorrhoe, die in der Adoleszenz beginnt und durch langanhaltende, schmerzhafte Uteruskontraktionen während der Menstruation gekennzeichnet ist, von einer sekundären Dysmenorrhoe, der eine Sonderform der Endometriose, eine Adenomyosis uteri zugrunde liegen kann. Die Schmerzen beginnen zumeist 1–2 Tage vor Eintreten der Regelblutung.
Der therapeutische Ansatz wäre eine rechtzeitige symptomatische Therapie mit Antiphlogistika, eine Ernährungsumstellung, eine Gestagentherapie zur Rythmisierung des Zyklus oder eine orale Kontrazeption ev. im Langzyklus.
Das Prämenstruelle Syndrom kann körperliche Symptome wie
• Wasseransammlungen im Körper
• Gewichtszunahme
• Hautveränderungen
• Müdigkeit, Abgeschlagenheit, Erschöpfungssymptome
• Übelkeit
• Magen-Darm-Beschwerden
• Krämpfe im Unterleib
• Kopf- und Rückenschmerzen
• Heißhunger oder Appetitlosigkeit
• schmerzhaftes Ziehen in den Brüsten/extreme Empfindlichkeit gegenüber Berührung – die so genannte Mastodynie
• erhöhte Sensibilität auf Reize (Licht, Berührung, Lärm, Geruch, Zeit- und Arbeitsdruck)
• Migräne
• Ohnmacht hervorrufen.
Bei manchen Betroffenen stehen seelische Symptome wie
• Stimmungsschwankungen (Gemütslabilität)
• Antriebslosigkeit
• Hyperaktivität
• Depressionen
• oder „manische“ Phasen
• Angstzustände
• Reizbarkeit
• Aggressivität im Vordergrund.
Auch hier empfiehlt sich eine Therapie auf vielen Ebenen, wie Sport und Bewegung, autogenes Training, Entspannung, Massagen, Bäder und auf der medikamentösen Ebene z. B. Mönchspfeffer, Nachtkerzenöl oder Selektive Serotonin Wiederaufnahme Hemmer (SSRI).
Mädchensprechstunden und Klassenführungen sind der sexualpädagogische Auftrag an die Kinder und Jugendgynäkologie: Die First love Ambulanzen bzw. sexualpädagogische Fragestunden im Krankenhaus stellen ein niederschwelliges Angebot für Jugendliche dar, sich mit ihrem Körper und ihrer Sexualität auseinanderzusetzen. Kontrazeptionsmethoden und mögliche Veränderungen und Beschwerden in der Pubertät werden besprochen. Viele zumeist codierte Fragen werden altersgerecht bearbeitet. Das Durchspielen einer gynäkologischen Untersuchung mit allen Instrumenten, samt Ultraschall und einer Körperreise, die Mythen rund um die Anatomie beider Geschlechter und Sexualität auflösen soll, wird gemeinsam mit einer Sexualpädagogin in Kleingruppen organisiert.
Pathologische Blutungen in Adoleszenz und reproduktiver Phase
In der Pubertät und Adoleszenz zeigen sich umfassende hormonelle und körperliche Veränderungen, die auf eine Synthese von GnRH, LH, FSH und einen Anstieg der Östradiolspiegel zurückzuführen sind. Die somatischen Entwicklungsstadien werden nach Tanner im Bereich der Mammae, Axillae und den Labien in 5 Grade eingeteilt. Die Thelarche wird als Entwicklung der Brust ab dem 10. Lebensjahr definiert. Als Pubarche fasst man die Scham- und Axillarbehaarung zusammen. Bezüglich des Längenwachstums zeigt sich in der Pubertät ein entsprechender Wachstumsschub. Die Menarche, die bei den meisten Mädchen im Zeitraum zwischen dem 11. und 15. Lebensjahr anzusetzen ist, wird zumeist anovulatorische Zyklen für 2–3 Jahre beinhalten. In der Scheide verändert sich die vaginale Besiedelung mit Döderlein-Bakterien zum Schutz der Flora. Im Ultraschall kann eine Größenzunahme des Uterus gemessen werden.
Ursachen für eine abnormale vaginale Blutung in der Adoleszenz sind vielfältig:
• Anovulation
• Essstörungen
• starke sportliche Betätigung
• chronische Erkrankungen
• Alkohol- und Drogenmissbrauch
• Stress
• Schilddrüsenerkrankungen
• Diabetes mellitus
• hormonelle Störungen
• PCOS
• Hyperandrogenismus
• Schwangerschaft
Mögliche organische Ursachen:
• Myome, Polypen, Endometriumhyperplasie
• Mayer-Rokitansky-Küster-Syndrom
• exogene Hormone
• Infektionen z. B. Chlamydien
• hämatologische Erkrankungen
• thrombozytopenische Purpura
• Willebrand-Jürgens-Syndrom
• Leukosen
In der Frauenheilkunde finden sich zahlreiche Definitionen für Zyklustempo- und Blutungsanomalien wie z. B.:
• Eumenorrhoe
• Hypomenorrhoe
• Brachymenorrhoe: Blutungsdauer < 3 Tage
• Hypermenorrhoe
• Menorrhagie: sehr starke und lange Blutung
• Metrorrhagie: Zwischenblutungen
• Polymenorrhoe: Intervall < 25 Tage
• Oligomenorrhoe: Zyklusdauer > 35 Tage
• Mittelblutung
• azyklische Dauerblutung
• prä- u. postmenstruelles Spotting
• primäre u. sekundäre Amenorrhoe
Als Beispiel einer hormonellen Störung bei Blutungsanomalien sollte das PCOSpolyzystisches Ovar-Syndrom angeführt werden. Anamnestisch finden sich eine Oligo- oder Amenorrhoe, Anovulation oder azyklische Durchbruchblutungen. Laboranalytisch zeigt sich eine Hyperandrogenämie. Es wird im Hormonstatus Testostron, DHEAS, Androstendion ↑ und der LH/FSH-Quotient > 2 erhoben. Der klinische Hyperandrogenismus zeigt sich in Akne, Hirsutismus und einer männlichen Haarverteilung. Im Ultraschall sind als morphologischer Aspekt eines PCO mehr als 10 randständige Follikelzysten in den Ovarien definiert. Internistisch lässt sich eine periphere Insulinresistenz und Adipositas im Sinne eines metabolischen Syndroms erheben. Somit wird das PCO als Frühform des Metabolischen Syndroms angesehen, das durch eine Adipositas, Hypertriglyzeridämie, Hypertonus und gestörte Glukosetoleranz definiert ist. Infertilität ist in diesem Zusammenhang der häufigste Zuweisungsgrund an eine Frauenheilkunde. In der Literatur ist eine Assoziation vom PCO Syndrom mit einem erhöhten Risiko für die Entwicklung eines Endometriumkarzinoms beschrieben.
Ursache für vaginale Blutungen bei positivem Schwangerschaftstest ist eine Blutung in der Frühschwangerschaft. Mittels Vaginalsonografie erfolgt der Nachweis eines intrauterinen Gestationssackes ca. ab der 4.–6. Schwangerschaftswoche. Man unterscheidet eine Blutung bei intakter Gravidität, einen Abortus im Gange, eine missed abortion oder verhaltenen Abort bei negativer Herzaktion, einen drohenden Abort oder Abortus imminens bzw. eine Extrauteringravidität oder Tubargravidität. Bei frühen Schwangerschaften und zur Beurteilung des Schwangerschaftsverlaufes ist die Bestimmung des ß-hCG und Progesterons im Serum (48 h-Wert) indiziert. Bei Symptomen, wie starken Unterbauchschmerzen, starken vaginalen Blutungen empfiehlt sich eine stationäre Aufnahme zur Beobachtung und je nach Verlauf akute chirurgische Intervention mittels Abortus-Curettage oder Laparoskopie.
Organische Ursachen für vaginale Blutungen sind Leiomyomauteri, die bei 20–30 % aller Frauen > 30 Jahren zu beobachten sind. Von der Lokalisation unterscheidet man intramurale, subseröse, submuköse, gestielte Myome sowie eine diffuse Leiomyomatose und Adenomyosis uteri, die den gesamten Uteruskörper betreffen und entsprechend vergrößern können. Als Symptome werden bei Patientinnen mit Uterus myomatosus Hypermenorrhoe, Menometrorrhagie, Schmerzen und auch ein Abortus habitualis zu erheben sein. Weitere organische Ursachen für vaginale Blutungen können Endometriumpolypen, die bei Symptomatik mittels operativer Hysteroskopie abgetragen werden sollten, Zervixpolypen, die in den allermeisten Fällen gutartig sind, und das physiologische Ektropium an der Zervixoberfläche zu nennen. Bei einer ausgeprägten Ektopia portionis muss eine HPV-assoziierte Dysplasie ausgeschlossen werden. Bei Kontaktblutungen sollten die Ektopien nicht ohne vorangegangene histologische Befundung z. B. mit einer LEEP abgetragen werden.
Zusammenfassung der Differentialdiagnosen für Blutungsursachen in der reproduktiven Phase nach dem Ergebnis des Schwangerschaftstestes:
1. Preg-Test positiv: Abort (Abortus im Gange, missed abortion, Abortus imminens, Extrauteringravidität (EUG), Tubarabort)
2. Preg-Test negativ: organische Ursachen wie z. B.
• Uterusmyom, Uteruspolyp, Zervixpolyp
• dysfunktionelle Blutung, Zyklusunregelmäßigkeit
• Endometriose
• Verletzung, Missbrauch
• Ektopie (Kontaktblutung: Blutung nach Geschlechtsverkehr)
• Menarche
• Karzinom (Zervix- und Korpuskarzinom)
• Medikamenteneinnahme
Zusammenfassung der Therapie bei
• Abort: Observatio, Gestagene, relative Bettruhe bzw. Methergin, Saug-Curettage, eventuell Antibiose
• Extrauteringravidität: Methotrexat (MTX), Laparoskopie mit Tubektomie
• Polypen, Myome: diagnostische oder operative Hysteroskopie (HSK), Curettage, Polypabtragung (PE)
• Zyklusstörung: orale Kontrazeptiva, Gestagene in der 2. Zyklushälfte, GnRH-Analoga
Bei rezidivierenden therapieresistenten Menometrorrhagien in der Prämenopause: Endometriumablation. Hier gibt es unterschiedliche Systeme, die im Rahmen einer operativen Hysteroskopie als Goldnetz oder Ball/Schlitten zur Koagulation oder Abtragung des Endometriums zum Einsatz kommen.
Bei unstillbaren postpartalen Blutungen empfiehlt sich ein mit der Anästhesie konzertiertes stufenweises Vorgehen zur Gerinnungsstabilisierung: Nach medikamentöser Intervention und anhaltender starker Blutung sollte nach Begutachtung der Cervix und Abklärung von Geburtsverletzungen ein Bakri-Ballon ins Uteruscavum bzw. als Ultima Ratio eine postpartum-Hysterektomie durchgeführt werden.
Pathologische Blutungen in der Postmenopause
Differentialdiagnosen der Ursachen für Blutungen nach der Menopause nach der Häufigkeit geordnet sind:
• Atrophie (59 %)
• Polypen (12 %)
• Endometriumkarzinom (10 %)
• Endometriumhyperplasie (9,8 %)
• exogene Hormonsubstitution (7 %)
• Zervixkarzinom (< 1 %)
• Hämatometra, Pyometra (2 %)
Eine Vaginalatrophie ist auf einen chronischen Östrogenmangel zurückzuführen und kann sich als Erosionen, chronische Endometritis, Spotting und ein vulnerables atrophes Vaginalepithel manifestieren.
In der Histologie von Endometriumpolypen finden sich in 3 % Endometriumhyperplasein mit Atypien und in 0,8 % bereits Endometriumkarzinome. Eine hysteroskopische Entfernung wird laut Leitlinien bei Symptomatik und erhöhten Risikofaktoren für Karzinome empfohlen.
Zervixpolypen haben ein sehr niedriges Entartungsrisiko. Eine ambulante Abdrehung ist zulässig. Bei großen Polypen der Zervix ist eventuell eine Polypabtragung mit Curettage indiziert.
Endometriumhyperplasien können im histologischen Präparat einer glandulärzystischen Hyperplasie oder einer adenomatösen Hyperplasie, mit oder ohne Atypien zuzuordnen sein. Eine Hysterektomie (HE) bei adenomatöser Hyperplasie mit Atypien sollte in der Befundbesprechung empfohlen werden.
Weiters muss in der Anamneseerhebung eine mögliche Hormonersatztherapie (mit Östrogenpräparaten) und deren Therapiedauer abgefragt werden. Antikoagulation kann auch die Ursache postmenopausaler Blutungen darstellen.
Karzinome wie Endometriumkarzinome, Zervixkarzinome oder Uterussarkome müssen bei postmenopausalen Blutungen zytologisch bzw. histologisch ausgeschlossen werden.
Diagnostik der Postmenopausalen Blutung:
• Anamnese (Menopause, Medikamente, Vorerkrankungen, Familienanamnese)
• gynäkologische Untersuchung (inklusive Zervixzytologie)
• evtl. Endometriumsampling, Pipelle zur zytologischen Beurteilung
• Ultraschall: Endometriumbreite (> 6 mm, homogen, inhomogen)
• evtl. Labor, Tumormarker
• histologische Abklärung durch diagnostische Hysteroskopie und fraktionierte Curettage empfohlen!
• Endometriumablation bei therapieresistenter Hypermenorrhoe im Rahmen einer operativen Hysteroskopie oder Einlage einer Hormonspirale
Literatur
Wolf A., Esser-Mittag J. Bildatlas für Kinder- und Jugendgynäkologie, Schattauer Verlag, 2002.
Dickinson R. L. Atlas of Human Sex Anatomy, Krieger Pub Co., 1971.
Rechtsmedizin systematisch, Unimed, Bremen 2006.
Brinkmann B., Madea B. Handbuch gerichtliche Medizin, Springer, 2004.
Schätz T. et al. Fertility and Sterility, Vol 83, No 2, 2005.
Christian Dadak
Übersicht
• Symptome, Diagnose, Klinik
• DD
• akute – chronische – zyklische Schmerzen
• Endometriose
• Entzündungen
• Adnextumore
• Prolaps
Die Genitalorgane der Frau reagieren sehr häufig auf Stress, Emotionen und Beziehungsstörungen.
Typische Lokalisationen der Pelviopathie sind Genitalschmerzen, suprapubischer Schmerz, Schmerzen im Blasenbereich, Anus, der Leistengegend, im Lendenwirbelsäulenbereich sowie im Steißbein. Die Pelviopathie kann Beschwerden beim Sitzen, Schmerzen nach dem Stuhlgang, häufiger Harndrang, Brennen beim Urinieren, Schmerzen beim und nach dem Geschlechtsverkehr machen und Frauen reagieren häufig mit Angst und Depressionen sowie Hilflosigkeit in Bezug auf die Symptome.
Wichtig ist die Erstellung einer genauen Anamnese, einer klinischen Untersuchung und, wenn möglich, das Führen eines Schmerztagebuches. Zum Einsatz kommen auch verschiedene bildgebende Verfahren (vor allem der vaginale Ultraschall) und eventuell, falls kein exakter Befund erhebbar ist, auch eine diagnostische Laparoskopie.
Wichtig: ein Schwangerschaftstest ist immer durchzuführen, auch außerhalb des reproduktiven Alters, da es durchaus möglich ist, dass durch Eizellspende eine Schwangerschaft nach der Menopause eingetreten ist.
Verschiedenste Differentialdiagnosen wie gastrointestinale Erkrankungen, urogenitale Erkrankungen sowie neurologische und muskulo-skeletale Erkrankungen und auch andere seltene Erkrankungen sollten ebenfalls in die Überlegungen eingehen.
Gastrointestinale Erkrankungen
• Diverticulitis
• entzündliche Darmerkrankungen
• Reizdarmsyndrom
• Hernien
Urogenitale Erkrankungen
• Rezidivierende Zystitis
• Urethradivertikel
• Ureterobstruktion
• Beckenniere
• Bladder Pain Syndrome (vormals interstitielle Zystitis)
Neurologische Erkrankungen
• Neurinom
• Nervenkompressionssyndrom
Muskulo-skeletale Erkrankungen
• WS-Fehlstellungen (z. B. Skoliose)
• Spondylolysis
• Osteoporose
Andere Erkrankungen
• Lymphom
• Neurofibromatose
Man unterscheidet akute, chronische und zyklische Schmerzen. Bei positivem Schwangerschaftstest kann ein Abortus oder eine Extrauterinschwangerschaft (z. B. Tubaria) vorliegen (siehe die entsprechenden Kapitel).
Ein akuter Beckenschmerz tritt auf z. B. bei Entzündungen, Adnextumoren, Appendicitis, Diverticulitis, HWI/Pyelonephritis und Nephrolithiasis.
Von chronischen Schmerzen sprechen wir dann, wenn die Schmerzen länger als 3 (manche Autoren sagen 6) Monate dauern (Entzündungen, Adnextumore, Divertikulose, Cholezystolithiasis, Nephrolithiasis, Varikositas pelvis, Ileitis, Gleitwirbel, Coxitis, Bandscheibenprotusio).
Unter zyklischem Beckenschmerz verstehen wir Schmerzen, die in Zusammenhang mit dem Zyklus der Frau stehen, wie Dysmenorrhoe (schmerzhafte Regelblutung) und der sog. Mittelschmerz, der durch Platzen des Eibläschens in der Mitte des Zyklus verursacht wird.
a.) Primäre Dysmenorrhoe
Primäre Dysmenorrhoe ist eine schmerzhafte Menstruation ohne pathologischen Befund, mit Beginn typischerweise 1–2 Jahre nach der Menarche. Der Schmerzbeginn ist wenige Stunden vor oder nach Beginn der Menstruationsblutung und dauert bis zu 72 Stunden.
Verantwortlich dafür sind Prostaglandine und Leukotriene, die schmerzhafte uterine Kontraktionen auslösen. Betroffen ist aber auch die glatte Muskulatur von Magen und Darm, weshalb Übelkeit und Erbrechen ebenso auftreten können.
Allgemeine Maßnahmen wie Wärmetherapie, Kräutertherapie, Sport, mentales Training und alternativmedizinische Ansätze sind als Therapie anwendbar. Als medikamentöse Therapie kennen wir NSAR wie Parkemed®. Man kann aber auch orale Kontrazeptiva einsetzen oder eine Hormonspirale legen (keine Regelblutung mehr!).
b.) Sekundäre Dysmenorrhoe
Sekundäre Dysmenorrhoe ist eine schmerzhafte Menstruation mit zugrunde liegender Pathologie. Sie beginnt typischerweise erst einige Jahre nach der Menarche. Der Schmerzbeginn ist meist 1–2 Wochen vor der Menstruationsblutung und dauert bis einige Tage nach Ende der Blutung.
In Frage kommen dafür: Hymenalatresien, Zervikalstenosen, uterine Anomalien, Endometriose, das Asherman Syndrom, Adenomyosis und das Pelvic Congestion Syndrom. Die Therapie richtet sich nach der Diagnose.
Asherman Syndrom
Beim Asherman Syndrom handelt es sich um intrauterine Adhäsionen als Folge von intrauterinen Verletzungen. Meist liegt die Ursache bei zu intensiv ausgeführten Curettagen nach Abortus, Interruptio oder bei Plazentaretention, auch Infektionen können Ursache sein (Tuberkulose). Die gesamte Endometriumschicht wurde bei einer Curettage entfernt oder durch Entzündung zerstört.
Es kommt zu Infertilität, Zyklusunregelmäßigkeiten sowie Abortus habitualis. Nachgewiesen werden kann es durch Hysteroskopie und Hysterosalpingographie.
Therapeutisch stehen nur wenige Möglichkeiten zur Verfügung. Man kann versuchen durch hysteroskopische Adhäsiolyse und durch Östrogen/Progesteron Substitution das Endometrium von einzelnen Endometriuminseln ausgehend wieder zum Wachstum anzuregen.
Pelvic Congestion Syndrom – Varikositas pelvis
Dabei handelt es sich um eine Varikositas der uterinen und ovariellen venösen Plexen.
Die Symptome sind Dyspareunie, chronische UB-Schmerzen sowie Dysmenorrhe. Es gibt keine evidenzbasierte Therapie. Man kann versuchen Gestagene, GnRH-Analoga, orale Kontrazeptiva einzusetzen. Bei ausgeprägten Formen kann auch eine Embolisation oder Ligatur der Gefäße notwendig sein. Als Ultima Ratio steht die Adnexektomie oder die Hysterektomie nach abgeschlossenem Kinderwunsch zur Diskussion.
Eine weitere Form des zyklischen Schmerzes ist der sog. Mittelschmerz. Etwa 20 % aller Frauen spüren ihre Ovulation, was aber auch als Schmerz gespürt werden kann. Die Dauer des Schmerzes beträgt nur wenige Stunden bis maximal 2 Tage. Der Schmerz variiert von leicht bis stark. Hervorgerufen wird der Schmerz durch das Platzen des Follikels.
Die Endometriose verursacht vor allem Schmerzen um die Menstruation. Die Definition von Endometriose lautet: endometrium-ähnliches Gewebe außerhalb des Cavum uteri. Sie hat eine Inzidenz von 6–8 % in der normalen Bevölkerung; bei Sterilitätspatientinnen kann sie bei etwa 50 % der Frauen beobachtet werden.
Die Pathogenese der Endometriose ist unklar. Es gibt die Theorie der Transplantation und der Metaplasie. Dabei wirkt Östrogen als Stimulus.
Die Entstehung könnte über eine retrograde Menstruationsblutung inklusive Endometriumanteile über die Tuben in das Abdomen sein. Dann kommt es zur Stimulation der Endometrioseherde durch Östrogen und es gibt eine veränderte Immunantwort auf die körpereigenen Endometriumzellen, sodass sie mit Fremdgewebe (z. B. Peritoneum) Kontakt aufnehmen können und in sie einwachsen. Der Verlauf ist oft progredient und kann zu Dysmenorrhoe, Dyspareunie (schmerzhafter Geschlechtsverkehr) und Sterilität führen.
Diagnose
Die Anamnese und die klinische Untersuchung können zu der Verdachtsdiagnose Endometriose führen. Die Bildgebung (vaginaler Ultraschall, CT oder MRI) kann den Verdacht erhärten; der Goldstandard ist jedoch die Laparoskopie mit histologischer Beweissicherung. Der Serummarker CA 125 kann zur Verlaufskontrolle beitragen.
Lokalisation
Die Endometriose ist lokalisiert am Peritoneum, am Uterus, aber auch im Ovar („Schokoladenzyste“) und in der Gebärmutterwand (wird als Adenomyosis uteri bezeichnet) sowie die extragenitale Endometriose, die im Bereich des Darms aber auch der Harnblase, Leber, Niere vorkommt.
Makroskopisch handelt es sich um helle Bläschen mit Hyperämie und durch entzündliche Reaktionen kann es zu Narbenbildungen kommen.
Später werden sie dunkel bis schwarz verfärbte Herde (aufgrund der Hämosiderineinlagerungen), die von Narbengewebe umgeben sind.
Therapie
Die Therapie der Endometriose sieht folgendermaßen aus:
Hormontherapie und operative Therapie, meistens durch Laparoskopie; dabei werden sämtliche sichtbare Herde entfernt, Verwachsungen werden gelöst und falls notwendig eine Refertilisierung (d. h. Freilegung der Tuben) durchgeführt.
Als hormonelle Therapie stehen Gestagene, Östrogen-Gestagen-Kombinationen, Danazol sowie GnRH-Analoga zur Verfügung.
Je nachdem welches Therapieziel (Schmerzreduktion oder Kinderwunschbehandlung) im Vordergrund steht, richtet sich die Therapieart:
Bei Schmerzen können adjuvante Hormonbehandlungen, z. B. kontinuierliche Gestagenzufuhr, Einlage einer Hormon-Intrauterinspirale, Implanon®-Applikation, sowie nicht-steroidale Antirheumatika eingesetzt werden.
Bei Kinderwunsch werden durch Laparoskopie möglichst alle Endometrioseherde entfernt und danach sollte der Kinderwunsch (auch durch ivF) möglichst rasch umgesetzt werden, da die Endometriose eine hohe Rezidivwahrscheinlichkeit aufweist.
Näheres siehe Kapitel Endometriose.
Infektionen der Vagina
Bakterielle Kolpitis
Fischartig riechender, weißlicher vaginaler Ausfluss
Therapie: Metronidazol, Clindamycin
Candidiasis
Typischer, topfiger weißlicher Ausfluss, verursacht Juckreiz und Schmerz
Therapie: lokal mit Clotrimazol oder Miconazol, oral Fluconazol
Trichomoniasis (Protozoon:Trichomonas vaginalis)
Gelblich schaumiger Fluor
Therapie: Metronidazol, Partnerbehandlung!
Infektionen des Uterus
Hauptsächlich handelt es sich hierbei um die Endometritis (Erreger sind Chlamydia trachomatis, Gonokokken, Streptokokken, anaerobe Bakterien). Die Entzündung tritt nach Curettagen oder postpartal auf. Die Klinik ist gekennzeichnet durch Uteruskantenschmerz und Unterbauchschmerzen, Fieber, Zwischenblutungen, Leukozytose sowie CRP-Anstieg.
Therapie: Metronidazol, Clindamycin
Historisches: Ignaz Semmelweis, geb. 1.7.1817 Entdecker der Endometritis puerperalis (Kindbett- oder Wochenbettfieber), „Retter der Mütter“, und wie man durch einfache hygienische Maßnahmen (Hände waschen) diese meist tödliche Erkrankung vermeiden kann.
Die Adnexitis wird durch Anaerobia, Gardnerella, Chlamydien und Gonorrhoe verursacht. Die Klinik ist durch ein- oder beidseitigen Unterbauchschmerz, Portiolüftungsschmerz, Temperaturerhöhung über 38 ºC, zervikalen Ausfluss, Labor (Leukozytose und CRP-Anstieg) gekennzeichnet. Die Vaginalsonographie zeigt eine Wandverdickung der Tuben, freie Flüssigkeit und in fortgeschrittenen Fällen kann es zu einem Tuboovarialabszess kommen. Weiters tritt dann eine Peritonitis auf.
Die Therapie sieht Antibiotika und Schmerztherapie vor; zunächst parenterale Therapie (durch 48 Stunden) danach kann man bei Rückgang der Leukozytose und des CRPs auf Oraltherapie (allerdings auf längere Zeit) umstellen. Tritt dabei keine Verbesserung der Klinik ein bzw. bei Verschlechterung oder nicht deutlicher Abnahme der Symptomatik, kann ein Tuboovarialabszess ursächlich sein, der umgehend zu entfernen ist.
Entzündungen der Vulva werden hauptsächlich durch Herpes und Soor hervorgerufen.
Ein Bartholinischer Abszess (Abb. 1) kann einseitig oder beidseitig auftreten und ist besonders schmerzhaft.
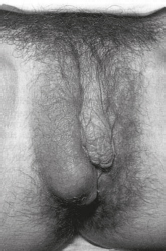
Abb. 1. Bartholinischer Abszess
Sobald der Abszess eingeschmolzen ist, werden eine Inzision, eine Spülung sowie die Einlage einer Lasche durchgeführt. Spontane Perforationen mit Pus-Entleerung können allerdings ebenfalls auftreten.
Von chronischer Pelveopathie sprechen wir, wenn ein andauernder, quälender Schmerz im Unterbauch der Frau von mind. 5–6 Monaten zu erheben ist. Risikofaktoren für die Entstehung einer somatoformen Schmerzstörung sind Stresserfahrungen in der Kindheit, emotionale Vernachlässigung, psychische Erkrankung der Eltern, Armut und Gewalterfahrungen. Zusätzlich kennen wir auch noch Hypermenorrhoe, Alkohol- und Drogenmissbrauch sowie Angst und Depression als Risiko.
Mögliche Ursachen sind Endometriose, Adenomyosis uteri, Adhäsionen, Varikositas pelvis, Fehlbildungen, Myome, Malignome, Pelvic Inflammatory Disease, Adhäsionen, St. p. Sectio caesarea, St. p. Aborte und St. p. Strahlentherapie des Beckens. Die Differentialdiagnosen sind gastrointestinal, urogenital, neurologisch, muskuloskeletal und andere.
Mögliche Ursachen der CPP – Urologie
• interstitielle Zystitis
• Blasenfunktionsstörung
• chronischer HWI
• Urolithiasis
Mögliche Ursachen der CPP – Gastrointestinal-Trakt
• Colon irritabile
• chronische Obstipation
• chronisch-entzündliche Darmerkrankung
• maligne intestinale Erkrankung
• Dünn- oder Dickdarmstenosen
• Divertikulitis
Mögliche Ursachen der CPP – sonstiges
• Fibromyalgie
• chronische Rückenschmerzen
• Nervenkompressionssyndrom
• Neuralgien/neuropathische Schmerzen
• Hernien
Diagnose
Interdisziplinärer Zugang zum Ausschluss einer organischen Ursache. Falls sich keine Diagnose stellen lässt, sollte eine diagnostische Laparoskopie ins Auge gefasst werden.
Therapie
Es gibt folgende medikamentöse Therapien: Ovulationshemmer, Gestagene, GNRH-Analoga und Prostaglandinsynthesehemmer. Des Weiteren können Analgetika und Antidepressiva zum Einsatz kommen. Sollte ein psychosomatischer Hintergrund bestehen, wäre ein psychotherapeutisches Konsil empfehlenswert.
Bei der operativen Abklärung durch Laparoskopie kann eine Adhäsiolyse und auch eine uterosacrale Nervenablation (LUNA) oder eine präsacrale Neurektomie als Ultima Ratio durchgeführt werden.
Oft ist die Patientin, wenn bei der Laparoskopie kein pathologischer Befund erhoben wird, danach beruhigt und schmerzfrei.
Die Klinik besteht aus Dysurie, Pollakisurie und Hämaturie sowie suprapubischen Schmerzen.
Die Diagnose von Harnwegsinfekten wird gestellt durch einen Streifentest mit positiven Leukozyten, Nitrit und ev. Blut. Unter Umständen sollte ein Uricult (eine Harnkultur) anlegt werden.
Bei aufsteigendem Harnwegsinfekt (Pyelitis) kommt es zu Flankenschmerzen, Leukozytose sowie erhöhtem CRP.
Die Therapie ist eine Antibiose, zusätzlich sollte die Empfehlung gegeben werden viel zu trinken sowie den Harn durch Preiselbeersaft oder Cranberries anzusäuern.
Adnexprozesse können zwar getastet werden, aber viel besser ist die Abklärung durch einen vaginalen Ultraschall. Dabei lassen sich einfache Zysten (ein- bis max. zweikämmerig, echoleer, ohne Binnenechos, glattwandig und scharf begrenzt) feststellen. Eine ev. Septumbrücke misst weniger als 3 mm im Durchmesser.
Komplexe Zysten sind mehrkämmerig, die Septumdicke beträgt mehr als 3 mm, der Inhalt ist inhomogen und die Binnenstrukturen sind unscharf begrenzt.
Meistens handelt es sich bei den einfachen Zysten um funktionelle Zysten und meist sind sie nach der Menstruation verschwunden, daher Kontrolle nach 1–3 Monaten, unmittelbar nach Ende der Menstruation. Nur bei weiterem Wachstum bzw. Beschwerden kommt eine operative Sanierung in Frage.
Komplexe Zysten sind z. B. Endometriosezysten sowie maligne Neubildungen und müssen unbedingt histologisch abgeklärt werden.
Genitalprolaps
Ein Genitalprolaps (Abb. 2 und 3) verursacht ebenso Schmerzen. Dabei kommt es beim Pressen und beim aufrechten Stand zur Vorverlagerung der Scheide mit dem Uterus vor die Vulva, später kommt es dann auch ohne Pressen zum Austritt der Genitalorgane.
Die Therapie besteht hauptsächlich aus verschiedenen operativen Eingriffen oder durch Anwenden eines Pessars (Abb. 4) bei Kontraindikationen für einen operativen Eingriff.
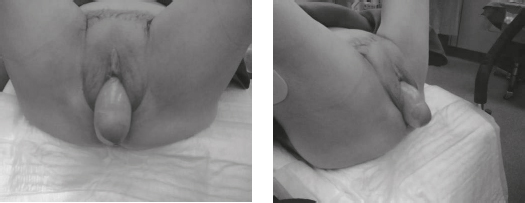
Abb. 2 und 3. Genitalprolaps

Abb. 4. Pessar
Literatur
Howard FM. Chronic pelvic pain. Obstet Gynecol. 2003 Mar; 101 (3): 594–611.
Gynäkologische Pathologie I
Pathologie benigner Mammatumore und des Mammakarzinoms
Zsuzsanna Bago-Horvath
Übersicht
• wichtigste Formen gutartiger Brustveränderungen
• histologische Klassifizierung, Grading und Staging des Mammakarzinoms
• Grundlagen der histologischen Diagnosestellung beim Mammakarzinom
• Grundlagen der Bestimmung prognostischer und prädiktiver Faktoren beim Mammakarzinom, inklusive multigenomischer Assays
Der hier angeführte Text stellt lediglich einen kurzen Auszug aus den geforderten Lernzielen dar. Zur Vollständigkeit wird auf die entsprechenden Kapitel des empfohlenen Lehrbuches verwiesen (Höfler/Kreipe/Moch: Lehrbuch Pathologie, 6. Aufl., ISBN: 978-3-437-42390-1).
Das Mammakarzinom ist die häufigste maligne Tumorerkrankung der Frau. Obwohl die Inzidenz der Erkrankung in den letzten Jahrzehnten gestiegen ist, zeigt die Mortalität eine eindeutig rückläufige Tendenz. Diese Verbesserung der Lebenserwartung ist einerseits den verbesserten Diagnosemöglichkeiten, andererseits der enormen Weiterentwicklung therapeutischer Interventionsmöglichkeiten zu verdanken. Bei beiden Entwicklungen kommt der pathologischen Diagnostik eine Schlüsselrolle zu. Das Kapitel behandelt auch Empfehlungen zur Diagnostik und Therapie.
Verdächtige Tastbefunde (Knoten in der Brust) oder suspekte Veränderungen, die durch bildgebende Verfahren entdeckt wurden (z. B. Mikroverkalkungen, Herdbefunde, Architekturstörungen), müssen nach derzeit gültigen Empfehlungen in jedem Fall vor einer Operation mittels Biopsieverfahren und histopathologischer Untersuchung abgeklärt werden, um die erforderliche operative oder medikamentöse Therapie festzustellen. Eine exakte Diagnosestellung ist nur in Kenntnis der klinisch-radiologischen Parameter (Größe, Lokalisation, radiologische Beschreibung der Veränderung) gewährleistet. Die histologische Diagnose beinhaltet neben der Beschreibung die sogenannte B-Klassifikation. Diese Klassifikation bestimmt, ob die diagnostizierte Veränderung mit den klinisch-radiologischen Parametern im Einklang ist und welche weitere diagnostisch-therapeutische Vorgehensweise die Diagnose erfordert. Eine Zusammenfassung der B-Klassifikation stellt Tabelle 1 dar.
Tab. 1. B-Klassifikation bei Stanzbiopsien von Brustveränderungen
| Klassifikation | Definition | Handlungsempfehlung |
| B1 normal/nicht repräsentativ |
normales oder nicht interpretierbares Gewebe | weitere Diagnostik, falls Diskrepanz mit Radiologie |
| B2 gutartig |
benigne Läsionen Fibroadenom, sklerosierende Adenose, kleine intraduktale Papillome, Abszess, Fettgewebsnekrose | Diagnostik abgeschlossen, falls im Einklang mit Radiologie |
| B3 gutartig, aber mit erhöhtem Risiko für Malignom |
Läsionen mit unklarem Malignitätspotenzial ADH, LIN, große/multiple papilläre Läsionen, radiäre Narbe, komplexe sklerosierende Läsion, Phylloides Tumor, Zylinderzellläsionen mit Atypie | weitere diagnostische Biopsie, multidisziplinäres Konsilium, KEINE SOFORTIGE THERAPIE! |
| B4 suspekt |
Verdacht auf Malignität z. B. Nachweis einzelner Tumorzellen ohne feingeweblichen Zusammenhang | weitere diagnostische Biopsie erforderlich, KEINE SOFORTIGE THERAPIE! |
| B5 maligne |
a. intraduktales Karzinomb. b. invasives Karzinomc. c. Invasionsstatus nicht beurteilbard. d. anderer maligner Tumor |
Therapie erforderlich |
Am häufigsten werden folgende gutartige Veränderungen (B2) diagnostiziert:
• entzündliche Veränderungen
• Fibroadenome
• Metaplasien
• intraduktale Epithelproliferation ohne Atypie
• Adenose
• fibrös-zystische Mastopathie
Häufige Läsionen mit erhöhtem Malignitätspotential (B3, Abb. 1):
• atypische intraduktale Epithelproliferation, atypische lobuläre Hyperplasie/ lobuläre Neoplasie
• intraduktale Papillome
• radiäre Narbe
• Phylloides-Tumore
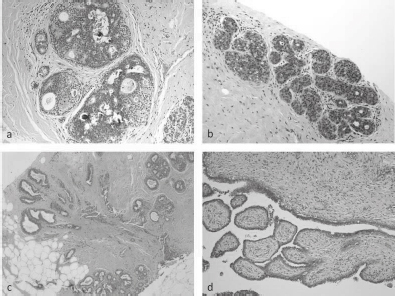
Abb. 1. B3-Läsionen
a. intraduktale Epithelproliferation mit Atypie; b. lobuläre Neoplasie; c. radiäre Narbe; d. benigner Phylloides-Tumor
Pathologische Diagnostik des Mammakarzinoms
Im Falle eines bioptisch diagnostizierten Mammakarzinoms erfolgt die Bestimmung folgender pathologischen Parameter am Biopsiematerial:
• ob es sich um ein invasives oder in situ Mammakarzinom handelt
• invasive Karzinome: histologischer Typ (nach WHO); die häufigsten Subtypen sind das invasive (duktale) Karzinom NST (no special type) und das invasive lobuläre Mammakarzinom (Abb. 2)
• Grading: Differenzierungsgrad; getrennt für in situ und invasiven Tumoranteilen
• prognostische und prädiktive Marker für Therapieempfehlung, mittels Immunhistochemie: Östrogen-Rezeptor (ER), Progesteron-Rezeptor (PR), HER2, Proliferationsmarker Ki67
Nach derzeit gültigen Richtlinien sollen HER2-positive und tripel negative (ER-, PR-, HER2-) Mammakarzinome vor einer Operation medikamentös durch Chemotherapie vorbehandelt werden. Aus diesem Grund ist die Bestimmung der oben genannten Faktoren bei der Diagnosestellung unerlässlich.
Nach erfolgter bioptischer Sicherung der Diagnose eines Mammakarzinoms kann die optimale operative Therapie festgelegt werden. Diese beinhaltet beim invasiven Mammakarzinom neben der kompletten Exzision des Tumorgewebes auch die operative Entfernung des Sentinel-Lymphknotens, des ersten axillären Lymphknotens im Abflussgebiet des Tumors. Die Resektionsränder des Tumorgewebes und ein eventueller Tumorbefall des Sentinellymphknotens können intraoperativ mittels Gefrierschnittuntersuchung bestimmt werden. Früher wurde beim Tumorbefall des Sentinellymphknotens eine zusätzliche axilläre Lymphknotendissektion durchgeführt. Aktuelle Studien zeigen, dass beim Befall 1–3 Sentinellymphknoten führt die Entfernung weiterer axillärer Lymphknoten zu keiner Verbesserung des Überlebens.
Die adjuvante Therapieempfehlung nach erfolgter Operation richtet sich meist nach den pathologischen Parametern, wie Grading, Stage ER-, PR-, HER2-Status und Proliferationsindex (Ki67). Anhand der immunhistochemischer Expression dieser Faktoren können die sogenannten intrinsischen Subtypen des Mammakarzinoms bestimmt werden, obwohl ihre Definition auf molekulargenetische Untersuchungen beruht. Das Ergebnis dieser Untersuchungen wird auch in den aktuellen Empfehlungen zur Stadieneinteilung des invasiven Mammakarzinoms berücksichtigt.
Beim ER-positiven, HER2-negativen invasiven Mammakarzinom kann ein kommerziell verfügbarer, multigenomischer Assay zur adjuvanten Therapieempfehlung herangezogen werden. Diese Assays werden meistens dann empfohlen, wenn anhand der klinisch-pathologischen Parameter alleine keine eindeutige Empfehlung zur Gabe einer adjuvanten Chemotherapie getroffen werden kann. Die am meisten verwendeten Assays sind Oncotype Dx, Mammaprint, Prosigna und Endopredict. Diese Assays sind durch die Analyse des mRNA-Expressionsmusters in der Lage, eine genauere prognostische Aussage bezüglich Rezidivrisiko im Vergleich zu klassischen klinisch-pathologischen Parametern zu liefern. Zwei dieser Tests (Oncotype DX und Mammaprint) wurden auch in prospektiv-randomisierten klinischen Studien bezüglich ihrer prädiktiven Wertigkeit evaluiert.
Nach epidemiologischen Studien sind etwa 5–10 % aller Mammakarzinome durch hereditäre Keimbahnmutationen relevanter Gene verursacht, wobei diesbezüglich es beträchtliche Unterschiede zwischen den einzelnen Subtypen gibt. So konnte gezeigt werden, dass bei tripel-negativen Mammakarzinomen bis zu 20–30 % aller Erkrankungen auf Mutationen der Genen BRCA 1 oder 2 zurückzuführen sind. Andere Gene, deren Mutationen mit einer signifikant erhöhten Mammakarzinomrisiko vergesellschaftet sind, sind PTEN, CDH1, PALB2, CHEK2, STK1, ATM, NBN und BARD1.
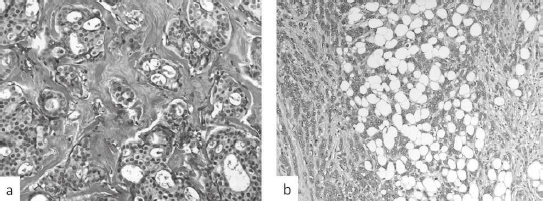
Abb. 2
a. invasives (duktales) Mammakarzinom NST; b. invasives lobuläres Mammakarzinom
Literatur
Gerald Höfler, Hans Kreipe, Holger Moch: Lehrbuch Pathologie. 6. Auflage ISBN: 9783437423901
James D. Brierley, Mary K. Gospodarowicz, Christian Wittekind. TNM Classification of Malignant Tumours, 8th Edition Wiley, ISBN: 978-1-119-26357-9
Lakhani SR, Ellis IO, Schnitt SJ, Tan PH, van de Vijver MJ. WHO Classification of Tumours of the Breast 4th Edition Volume 4, ISBN-13: 978-92-832-2433-4
Giuliano AE, Ballman KV, McCall L, Beitsch PD, Brennan MB, Kelemen PR et al. Effect of Axillary Dissection vs No Axillary Dissection on 10-Year Overall Survival Among Women With Invasive Breast Cancer and Sentinel Node Metastasis: The ACOSOG Z0011 (Alliance) Randomized Clinical Trial. JAMA. 2017 Sep 12; 318 (10): 918–926. doi: 10.1001/jama.2017.11470.
Sparano JA, Gray RJ, Makower DF, Pritchard KI, Albain KS, Hayes DF et al. Adjuvant Chemotherapy Guided by a 21-Gene Expression Assay in Breast Cancer. N Engl J Med. 2018 Jul 12; 379 (2): 111–121. doi: 10.1056/NEJMoa1804710.
Cardoso F, van't Veer LJ, Bogaerts J, Slaets L, Viale G, Delaloge S et al. 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med. 2016 Aug 25; 375 (8): 717–29. doi: 10.1056/NEJMoa1602253.
Gynäkologische Pathologie II
Pathologie der Ovarialtumore und des Ovarialkarzinoms
Zsuzsanna Bago-Horvath
Übersicht
• Klassifizierung der Ovarialtumore nach Herkunft und Differenzierung
• Aufgaben und Grundlagen der histopathologischen Diagnostik
• Grundlagen der histopathologischen Staging
• Charakterisierung epitheliealer Ovarialtumore
• Grundlagen der Diagnostik ovarieller Tumoren bei hereditären Tumorsyndromen
• wichtigste Formen Keimstrang-Stromatumore und Keimzelltumore
Der hier angeführte Text stellt lediglich einen kurzen Auszug aus den geforderten Lernzielen dar. Zur Vollständigkeit wird auf die entsprechenden Kapitel des empfohlenen Lehrbuches verwiesen (Höfler/Kreipe/Moch: Lehrbuch Pathologie, 6. Aufl., ISBN: 978-3-437-42390-1).
Tumore des Ovars sind hinsichtlich ihrer Herkunft, Dignität, klinischen Verlaufs und therapeutischen Möglichkeiten sehr heterogen. Die Rolle der pathologischen Diagnostik ist die genaue Charakterisierung dieser Tumore inklusive exakter Bestimmung der Entität und genaue Ausbreitung der Läsion. Der pathologische Befund bildet die Grundlage für weitere therapeutische Interventionen.
Nach ihrer Herkunft können primäre Ovarialtumore von metastatischen Absiedelungen Tumore anderer Lokalisationen unterschieden werden. Die häufigsten Vertreter der primären ovariellen Tumore sind epitheliale, Keimstrang-Stroma- und Keimzelltumore. Darüber hinaus existieren weitere, seltene primäre Tumore des Ovars, sowie metastatische Absiedlungen Karzinome anderer Lokalisationen. Bei den Metastasen handelt es sich häufig um Absiedelungen primärer gastrointestinaler Tumore (Krukenberg-Metastasen) oder lobulärer Mammakarzinome.
Diese Tumore sind am häufigsten unter den Ovarialtumoren (70–80 %). Sie werden hinsichtlich ihrer Dignität histologischen Differenzierung in 3 Gruppen unterteilt:
• (Zyst-)Adenome (eindeutig benigne)
• Borderline Tumore (morphologische Eigenschaften und klinischer Verlauf intermediär, zelluläre Atypien, Metastasierung möglich, Abb. 1)
• (Zyst-)Adenokarzinome (eindeutig maligne)
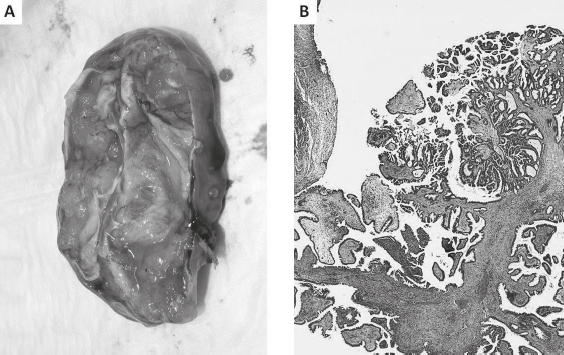
Abb. 1. serös-papillärer Borderline Tumor
A. septierte zystische Raumforderung mit papillären Proliferaten; B. histologisch papilläre Tumorformationen mit einem atypischen Epithel, keine Stromainvasion.
Bei Adenokarzinomen können wiederum 2 prognostisch relevante Subgruppen unterschieden werden, die signifikante Unterschiede bezüglich genetischen Alterationen und Morphologie aufweisen. Typ I (low grade) Tumore zeigen einen eher indolenten klinischen Verlauf, sind bei der Diagnose häufig auf das Organ beschränkt und sind durch eine vergleichsweise genetische Stabilität gekennzeichnet. Sie weisen selten Mutationen des TP53 Gens auf, stattdessen enthalten sie häufig Mutationen in den Genen KRAS, BRAF, PTEN, CTNNB1, ERBB2 und PIK3CA. Die genetischen Veränderungen sind charakteristisch für die jeweilige histologische Differenzierung.
Bezüglich ihrer histologischen Differenzierung können Typ I epitheliale Ovarialtumore in folgende Subtypen unterschieden werden:
• serös-papillär (low grade)
• muzinös
• endometrioid
• transitional cell (Brenner-Tumor, ähnelt Urothelium)
Typ II Ovarialkarzinome weisen hingegen in über 80 % Mutationen im TP53 Gen auf. Es können folgende Subtypen unterschieden werden:
• serös-papillär (high grade)
• undifferenziert
• Müller´scher Mischtumor (Karzinomsarkom)
Immunhistochemische und genetische Untersuchungen deuten darauf hin, dass diese Tumore, die früher als primäre Ovarialtumore bezeichnet wurden, eher sekundär von anderen Organen auf das Ovar übergreifen. So konnte gezeigt werden, dass serös-papilläre Tumore aus abgeschilferten Tubenepithelzellen entstehen, die bei einer Ovulation aus der Tube sich ins Ovar einnisten können. Endometriode oder klarzellige Tumore entstehen am ehesten aus Endometrioseherden, die abnormale Ansiedelungen von Endometriumschleimhaut außerhalb des Uterus darstellen. Transitionalzell-(Brenner-)Tumore und muzinöse Tumore könnten aus Urothel-ähnlichen Zellnestern am tubomesothelialen Übergang durch metaplastische Prozesse entstehen. Diese Einteilung wird durch die derzeit gültige WHO-Klassifizierung der Ovarialtumore widergespiegelt.
Die Einteilung erfolgt nach derzeit gültigen pTNM/FIGO-Kriterien. Epitheliale Ovarialtumore weisen die höchste Mortalität unter allen gynäkologischen Malignomen auf. Das Gesamtüberleben der Patientinnen ist stark vom Stadium und histologischen Subtyp der Erkrankung abhängig.
Ovarialkarzinome bei hereditären familiären Tumorsyndromen sind für etwa 5–10 % aller Erkrankungen verantwortlich. Sie werden am häufigsten durch Mutationen der BRCA1 und BRCA 2 Gene oder in Genen der HNPCC-Gruppe (MSI, Lynch-Syndrom) verursacht.
Diese Tumore leiten sich vom ovariellen Stroma ab und sind für etwa 5–10 % aller Ovarialtumore verantwortlich. Sie können aus Granulosa-, Theca-, Sertoli- oder Leydig-Zellen bestehen und die Tumore werden nach diesen vorherrschenden Zelltypen benannt (Abb. 2). Meistens machen sich diese Tumore durch paraneoplastische endokrine Symptome (verursacht durch Hormonproduktion durch die Tumorzellen) bemerkbar. Immunhistochemisch exprimieren die Tumore meistens alpha-Inhibin und Calretinin.
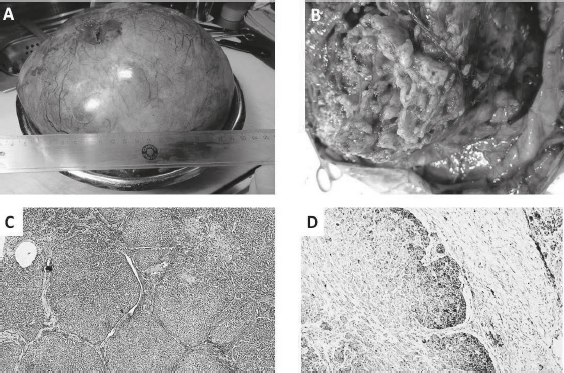
Abb. 2. Granulosazelltumor
A. große, glattwandige zystische Raumforderung (35 cm Durchmesser); B. das Granulosazelltumor kann makroskopisch solide oder papilläre Areale ausweisen; C. histologisch ist der Tumor durch solide oder rosettenförmige Zellverbände charakterisiert (20 x); D. immunhistochemische Expression von alpha-Inhibin (100 x)
Keimzelltumore
Keimzelltumore leiten sich von embryonalen Keimzellen ab. Sie verursachen etwa 10–20 % aller Ovarialtumore. Folgende Entitäten werden unterschieden:
• Teratome
• embryonales Karzinom
• Dysgerminom
• Dottersacktumor
• Chorionkarzinom
In 95 % der Fälle handelt es sich um reife, zystische Teratome. Diese Tumore treten meist im jungen Alter auf und enthalten reife Gewebearten, die aus allen drei Keimblättern entstammen. Die häufigsten Bestandteile dieser Tumore sind:
• Haut und Hautanhangsgebilde
• glatte Muskulatur
• Fettgewebe
• Knorpel- und Knochengewebe
• respiratorisches oder intestinales Epithel
• seltener neuronales Gewebe (meistens Quelle undifferenzierter Tumoranteile)
In seltenen Fällen können reife Teratome einen vorherrschenden Gewebetyp enthalten, z. B. Schliddrüsengewebe (Struma ovarii).
Chorionkarzinome können nach Molenschwangerschaften auftreten. Die schwangerschafts-assoziierten Chorionkarzinome zeigen eine vorteilhaftere Prognose im Vergleich zu sporadisch aufgetretenen Fällen.
Literatur
Gerald Höfler, Hans Kreipe, Holger Moch: Lehrbuch Pathologie. 6. Auflage, ISBN: 9783437423901
James D. Brierley, Mary K. Gospodarowicz, Christian Wittekind. TNM Classification of Malignant Tumours, 8th Edition Wiley, ISBN: 978-1-119-26357-9
Kurman RJ, Carcangiu ML, Herrington CS, Young RH. WHO Classification of Tumours of Female Reproductive Organs 4th Edition Volume 6, ISBN-13: 978-92-832-2435-8
Kurman RJ1, Shih IeM. The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am J Surg Pathol. 2010 Mar; 34 (3): 433-43. doi: 10.1097/PAS.0b013e3181cf3d79.
Sabine Dekan
Übersicht
Dieses Kapitel beschäftigt sich mit ausgewählten Themen der Gynäkopathologie.
Cervix uteri
• Dysplasie und Karzinom
• Zytologie
• Histologie
• HPV
• Vulva und Vagina
Corpus uteri
• epitheliale Läsionen
• mesenchymale Läsionen
• gestationsbedingte Trophoblasterkrankungen
Zytologie
Zytologie ist die Summe der Erkenntnisse über Morphologie und Funktionen der Zellen sowie die Lehre dieser Erkenntnisse.
Zytodiagnostik ist die mikroskopische Beurteilung von aus dem Gewebeverband gelösten Zellen und ein Verfahren um unter Anwendung der Erkenntnisse der Zytologie zu klinisch relevanten Diagnosen zu kommen.
Der Begriff Zytologie wird auch als Synonym für Zytodiagnostik verwendet.
Nomenklatur der gynäkologischen Zytologie
Beurteilbar
• beurteilbar und repräsentativ (geschätzt 8–10.000 gut erhaltene Plattenepithelzellen, Zylinderepithelzellen und/oder Metaplasiezellen)
• beurteilbar, aber:
– keine Zylinderepithel- und/oder Metaplasiezellen
– andere Ursachen (Blut, Entzündung etc.)
Nicht beurteilbar
Identifikation des Abstrichpräparates oder Zuordnung zu einer Anweisung nicht möglich.
Zerbrochenes oder nicht vorhandenes (nicht eingelangtes) Abstrichpräparat Repräsentativitätskriterien und technischen Verarbeitung:
• weniger als geschätzte 5.000 PEZ
• zu schlechte oder keine Fixierung
• Überdeckung von mehr als 75 % der epithelialen Zellkomponente durch: Blut, Entzündung, dicke Zelllagen, Kontamination, Quetschartefakte
Stärken: billig, schnell, nicht traumatisch, spezifisch (80–99 %)
Details
- Seiten
- 260
- ISBN (ePUB)
- 9783991118237
- Sprache
- Deutsch
- Erscheinungsdatum
- 2023 (September)
- Schlagworte
- Gynäkologie Sterilitätsbehandlung Frauenheilkunde Brusterkrankungen Dadak Geburtshilfe Gynäkologische Endokrinologie

