Zusammenfassung
Berücksichtigung finden u. a. die männliche und weibliche Endokrinologie, Biochemie sowie die physiologisch-anatomischen Veränderungen im sexuellen Reaktionszyklus und seine Ab¬weichungen. Die Sexualität und ihre verschiedenartigen Probleme werden im Kontext verschiedener Lebensabschnitte abgehandelt.
Auf die Reproduktion wird ebenso eingegangen wie auf die Entwicklung des Embryos, die Inter¬aktion zwischen Mutter und Fetus sowie die Schwangerschaft, die Geburt und das Wochenbett. In einem gesonderten Kapitel werden ethische und rechtliche Aspekte diskutiert – brand¬aktuelle Themen, die Gegenstand öffentlicher Diskussion sind.
Leseprobe
Inhaltsverzeichnis
- Cover
- Half Title
- Titel Seite
- Impressum
- Inhaltsverzeichnis
- Vorwort
- Einleitung
- Morphologie
- Meiose
- Histologie der weiblichen Geschlechtsorgane
- Histologie der männlichen Geschlechtsorgane
- Normale und gestörte Organentwicklung
- Die Geschlechtsentwicklung
- Fehlbildungen des weiblichen Genitales
- Klinische Embryologie – Organentwicklung Bildgebende Verfahren in der Pränataldiagnostik
- Genetik in der Reproduktionsmedizin
- Schädigung der Reproduktion und Entwicklung durch Fremdstoffe
- Praktische Fallbeispiele aus der Medikation in der Schwangerschaft
- Physiologie, Pathophysiologie und Klinik der Regelkreise
- Hypothalamus – Hypophyse
- Der Menstruationszyklus
- Biochemie der Sexualhormone
- Therapeutische und missbräuchliche Anwendung von Sexualsteroiden
- Pharmakologie der sexuellen Dysfunktion
- Weibliche Pubertät und Pubertas praecox
- Bedeutung der Sexualsteroide aus gynäkologischer Sicht inklusive der Extragenitalen Wirkungen
- Sexualität und Psychosomatik
- Einführung in die Sexualität – Störungen der sexuellen Funktion
- Klinik der Sexualmedizin
- Transgender-Ambulanz – ärztliche Beratung und Begleitung von Trans*Personen
- Sexualprobleme der Frau
- Die Bedeutung von Sexualität bei einzelnen psychischen Erkrankungen und in der psychiatrischen Behandlung
- Sexualität und chronische Krankheiten
- Sexualität und Medikamente
- Psychosomatik in der Geburtshilfe
- Infektionen
- Intrauterine, perinatale und postnatale Infektionen durch Viren mit Fallbeispielen
- Pränatale, perinatale und neonatale Infektionen durch Bakterien, Pilze und Protozoen
- Gynäkologie, klinische Endokrinologie und Sterilitätsbehandlung
- Sterilität – ursächliche Faktoren und Diagnostik
- Weibliche Sterilität, Therapie, Risiken der ART (OHSS) und Methoden zur Erhaltung der Ovar-Funktion
- Kontrazeption
- Menopause
- Andrologie
- Endokrinium des Mannes, männliche Sterilität
- Männliche Infertilität
- Sexuelle Funktionsstörungen des Mannes nach chirurgischen Eingriffen
- Sexualprobleme des Mannes
- Schwangerschaft und Geburt
- Physiologie der normalen Schwangerschaft
- Physiologie des Feten
- Schwangerschaftsvorsorge, Mutter-Kind-Pass
- Normale Geburt und Wochenbett
- Ethik, Rechts- und Gerichtsmedizin, Ethnomedizin
- Ethische Fragen am Lebensbeginn: Reproduktionsmedizin, Schwangerschaft und Geburt (in Zeiten der Corona-Pandemie)
- Sexualität, Reproduktion, Schwangerschaft und Geburt – Rechtliche Aspekte
- Weibliche Genitalverstümmelung (FGM) aus medizinanthropologischer Perspektive
- Umgang mit von Gewalt Betroffenen
- Ärztliche Untersuchung und Spurensicherung nach einem Sexualdelikt
- Ungewollte Schwangerschaft
- Gynäkologische und geburtshilfliche Untersuchungsmethoden
- Die gynäkologische Untersuchung
- Anhang
- AutorInnenverzeichnis
- Rückseite
Vorwort
Willkommen zur 12. Auflage des Blockbuchs 15 – Sexualität, Reproduktion und Schwangerschaft – einem umfassenden Leitfaden, der sich mit den vielfältigen Aspekten der Frauenheilkunde befasst. Die Gynäkologie ist ein faszinierendes medizinisches Fachgebiet, das sich mit der Gesundheit des weiblichen Fortpflanzungssystems befasst, angefangen von der Pubertät bis zur Menopause. In dem von Univ.-Prof. Christian Dadak konzipierten und von ihm über viele Jahre exzellent betreuten Lehrbuch werden wir die Anatomie, Physiologie und Pathologie der weiblichen Geschlechtsorgane erkunden und gleichzeitig einen tiefen Einblick in die Diagnose, Behandlung und Prävention gynäkologischer Erkrankungen bieten.
Die Gynäkologie hat im Laufe der Geschichte enorme Fortschritte gemacht, wobei innovative Technologien und medizinische Entdeckungen zu einer verbesserten Versorgung und Lebensqualität für Frauen auf der ganzen Welt geführt haben. Von der Reproduktionsmedizin über die Themen Schwangerschaft und Geburtshilfe bis hin zu ethisch-rechtlichen Aspekten sind die Themenbereiche, die diese Publikation abdeckt, von zentraler Bedeutung für die medizinische Versorgung von Frauen jeden Alters. In diesem Zusammenhang möchte ich auch Univ.-Prof. Harald Leitich für die Weiterentwicklung und Verfeinerung des Lehrbuchkonzepts hervorheben und mich bei all jenen Kolleg:innen bedanken, die mit ihren Beiträgen dieses Blockbuch bereichert haben.
Wir laden Sie ein, gemeinsam mit uns in die faszinierende Welt der Gynäkologie einzutauchen. Egal, ob Sie gerade erst Ihre medizinische Laufbahn beginnen oder bereits erfahrene Praktikerin oder erfahrener Praktiker sind – das Blockbuch 15 wird Ihnen wertvolles Wissen vermitteln und Ihnen helfen, die Gesundheit und das Wohlbefinden der Frauen, die Sie betreuen, optimal zu unterstützen.
Univ.-Prof Dr. med. Christian F. Singer, MPH
Es zeugt schon von Qualität, wenn die 12. Auflage unveränderte Inhalte aufweist. Diese spannen den Bogen vom Kinderwunsch bis zum Wochenbett, vom Normalen bis zur Pathologie. Stolz kann man auf den Fortschritt, dass erstmals der Sexualmedizin ein breiter Raum gewidmet wird, sein. Auch die männliche Seite wird beleuchtet. Besondere Aufmerksamkeit ist weiters für die Embryologie vorgesehen. Außerdem finden sich Rechtsmedizin, Gerichtsmedizin, Ethnomedizin sowie Ethik im Buch. Gynäkologie in all ihren Pathologien wird im Tertialbuch beschrieben.
Bedanken muss ich mich bei meinen Kolleginnen und Kollegen, die am Zustandekommen dieses Werks mitgeholfen haben. Der Dank gilt aber auch dem Facultas Verlag, insbesondere Theresa Gapp, Lea Schenner und Sigrid Neulinger. Sie waren die treibende Kraft für jährliche Neuauflagen des Blockbuchs.
Die Leserinnen und Leser mögen mit dem Buch sehr sorgsam umgehen, da es ihnen vielleicht während ihrer Ausbildungszeit als Nachschlagewerk dienen kann.
Ao. Univ.-Prof Dr. med. univ. Christian Dadak
Einleitung
Harald Leitich
Wie bereits aus dem Titel ersichtlich, sind die zentralen Themen des Blocks 15 die Sexualität, Reproduktion, Schwangerschaft und Geburt.
Dem Thema Sexualität wird im Block 15 breiter Raum eingeräumt, sodass es von den verschiedensten Blickwinkeln aus besprochen werden kann. Beispiele für diese differenzierte Betrachtungsweise des Themas Sexualität sind die Einheit von Psyche und Körper, sexuelle Funktionsstörungen und klinische Aspekte der Sexualmedizin, Sexualprobleme bei Frau und Mann, Fragen der Geschlechtsidentität und Transsexualität, die Sexualität aus psychiatrischer Sicht, oder Sexualität nach Operationen oder bei chronischen Erkrankungen. Dazu ergänzend wird die Psychosomatik in der Gynäkologie und Geburtshilfe als eigener Beitrag dargestellt.
Zur Einführung in das Thema Reproduktion werden zunächst der Aufbau und die Funktion der männlichen und weiblichen Geschlechtsorgane aus anatomischer, histologischer, physiologischer und biochemischer Sichtweise erklärt. Die Bedeutung der Steroidhormone wird durch eigene Beiträge zur therapeutischen und missbräuchlichen Anwendung der Steroidhormone näher unterstrichen. Ein weiterer Beitrag in diesem Zusammenhang behandelt die Formen der hormonellen und nicht-hormonellen Kontrazeption.
Die Entwicklung des Menschen wird von der Embryologie, der physiologischen Entwicklung des Feten bis zur Geburt, der Pubertät und dem reproduktiven Alter dargestellt und zuletzt von den Veränderungen in der Menopause abgeschlossen. Dabei wird einerseits die physiologische Entwicklung dargestellt, andererseits aber auf Störungen dieser Entwicklung durch Fremdstoffe, Medikamente, oder Infektionen, sowie auf Fehlbildungen des weiblichen Genitals und die Varianten der Geschlechtsentwicklung eingegangen. Aus klinisch-praktischer Sicht sind diese Störungen so- wie die genetisch bedingten Varianten der Entwicklung des Menschen wesentliche Inhalte des Beitrags zur Pränataldiagnostik.
Die Schwangerschaft und Geburt des Menschen werden in mehreren Beiträgen ausgeführt. Diese beschreiben die physiologische Entwicklung der Schwangerschaft, die Schwangerschaftsvorsorge, die normale Geburt und das Wochenbett. Die Beschreibung der Pathologie von Schwangerschaft, Geburt und Wochenbett ist nicht mehr im Themenumfang des Blocks 15 enthalten, sondern erfolgt ausführlich im Tertial Frauenheilkunde.
Da der unerfüllte Kinderwunsch ein Thema ist, das zunehmend an Bedeutung gewinnt, wird die Diagnostik und Therapie der weiblichen Sterilität, sowie die Bedeutung der Genetik in der Reproduktionsmedizin in eigenen Beiträgen abgehandelt. Der männlichen Sterilität ist ein eigener Beitrag gewidmet, der zusammen mit der Beschreibung des Endokrinums des Mannes, sowie der Sexualprobleme beim Mann und den sexuellen Funktionsstörungen des Mannes nach chirurgischen Eingriffen im Kapitel Andrologie zusammengefasst ist.
Der Beschreibung der ethischen und rechtlichen Aspekte von Reproduktion, Schwangerschaft und Geburt werden im Block 15 in einem eigenen Kapitel Raum eingeräumt. Ein eigener Beitrag in diesem Kapitel ist dabei der ungewollten Schwangerschaft gewidmet.
Ein besonderer Schwerpunkt in diesem Kapitel stellt die Darstellung der Formen von Gewalt dar. Einem einführenden Beitrag zu diesem Thema folgen das Vorgehen und die Spurensicherung nach Gewaltereignissen wie sexuellem Missbrauch, sowie ein eigener Beitrag zur weiblichen Genitalverstümmelung (FGM).
Morphologie
Meiose
Klara Weipoltshammer, Oliver Pusch, Gerhard Viehberger
Der Mensch ist ein Diplont, d. h. jede seiner somatischen Zellen beinhaltet einen doppelten Chromosomensatz (2n). Jeweils eines der Chromosomen stammt von der mütterlichen Eizelle, das zweite von der väterlichen Samenzelle. Insgesamt besteht das somatische menschliche Genom aus 23 Chromosomenpaaren: 44 Autosomen (1 bis 22) und 2 Geschlechtschromosomen (X bzw. Y; XX – weibliches Geschlecht; XY – männliches Geschlecht). Die Chromosomen bestehen direkt nach jeder Zellteilung aus einer Chromatide (1C). Soll die Zelle eine weitere Zellteilung durchlaufen tritt sie in die Synthesephase ein – an jede Chromatide (Matrize) wird ein zweiter DNA-Strang angebaut (2C).
Zur Entstehung eines neuen diploiden Individuums muss im Lauf der Keimzellentwicklung der in den Ausgangszellen (Oo- bzw. Spermatogonien) vorliegende diploide Chromosomensatz (2n: 46 Chromosomen) auf die Hälfte, den haploiden Chromosomensatz (1n: 23 Chromosomen), reduziert werden. Dieser Vorgang heißt Reifeteilung, Reduktionsteilung bzw. Meiose (meios: weniger). Zusätzlich wird während der Meiose das genetische Material neu rekombiniert.
Somit sind die Ziele der Meiose:
1) Bereitstellung befruchtungsfähiger Gameten durch Reduktion des Chromosomensatzes von diploid auf haploid
2) Rekombination des genetischen Materials durch den Vorgang des Crossing over
Die Meiose läuft in zwei aufeinander folgenden Teilungsschritten ab, die als „Erste Meiotische Teilung“ (Meiose I) und „Zweite Meiotische Teilung“ (Meiose II) bezeichnet werden.
Erste meiotische Teilung
In der ersten meiotischen Teilung werden die in den diploiden Ausgangszellen (2n/4C) vorliegenden homologen Chromosomenpaare, auf zwei Tochterzellen aufgeteilt, sodass am Ende der ersten meiotischen Teilung in jeder Tochterzelle jeweils ein Chromosomensatz (1n/2C) vorliegt. Außerdem findet in der Meiose I die Rekombination des genetischen Materials statt.
Wesentliche Voraussetzung für beide Prozesse ist die präzise Paarung der homologen Chromosomen, die in der Prophase I der Meiose erfolgt. Dabei legen sich die beiden homologen Chromosomen mit ihren jeweils 2 Chromatiden exakt aneinander und bilden Brücken zwischen den Chromatiden, die sogen. „synaptonemalen Komplexe“, aus. Gegen Ende dieses Paarungsvorganges sind Chromatidentetraden entstanden. In diesem Stadium erfolgt dann das „Crossing over“. Dabei kommt es zur Neukombination gepaarter Chromatiden. Das Ergebnis sind vier Chromatiden, bei welchen einzelne Abschnitte der Nicht-Schwester-Chromatiden ausgetauscht worden sind (Durchmischung des Genpools). Durch diesen Vorgang wird ermöglicht, dass auf einer neu zusammengefügten Chromatide Gene mütterlichen und väterlichen Ursprungs kombiniert vorliegen. Danach trennen sich die Chromatidentetraden und es entstehen wieder Chromosomenpaare, sogen. „Bivalente“, die in weiterer Folge auf die beiden Tochterzellen aufgeteilt werden. Alle wesentlichen Schritte finden in der Prophase I der Meiose statt, die aufgrund ihrer Komplexität in fünf Stadien unterteilt wird, wobei im weiblichen Geschlecht noch ein sechstes Stadium „eingeschoben“ wird (siehe Tabelle 1).
Tab. 1
| Prophase I | Leptotän | (leptos: zart; taenia: Band): Beginn der Chromosomenkondensation, wobei zunächst zarte Bänder sichtbar werden. Die Kernhülle bleibt bis zur Diakinese erhalten. Die Chromosomenenden sind an der inneren Kernmembran verankert und bleiben bis zu deren Auflösung in der Diakinese mit ihr in Kontakt. In den Chromatiden entstehen Doppelstrangbrüche. |
| Zygotän | (zyg-: vereinigen): Fortschreitende Chromosomenkondensation, Paarung der homologen Chromosomen und Ausbildung der synaptonemalen Komplexe. | |
| Pachytän | (pachys: dick): Maximale Chromosomenkondensation und abgeschlossene Chromosomenpaarung; Chromosomenpaare können nicht mehr getrennt wahrgenommen werden, Chromatidentetraden entstehen; Im Leptotän entstandene DNA-Brüche werden repariert: „Crossing over“ zwischen den Nicht-Schwester-Chromatiden einer Tetrade | |
| Diplotän | (diploos: doppelt): Auflösung der synaptonemalen Komplexe; Zerfall der Chromatidentetraden und neuerliches Entstehen von deutlich sichtbaren Chromosomenpaaren, die noch an den Stellen, wo „Crossing over“ stattge-funden hat, miteinander verbunden sind (Chiasmata). | |
| Diakinese | Ablösen der Chromosomenpaare von der sich auflösenden Kernhülle und Einleitung der Metaphase durch Ausbildung des Spindelapparates. | |
| Diktyotän | Stadium der Prophase I, welches ausschließlich im weiblichen Geschlecht nach dem Diplotän „eingeschoben“ wird und die Oozyten in der Prophase I bis kurz vor dem Follikelsprung „arretiert“. | |
| Metaphase I | Anordnung der Chromosomenpaare in der Äquatorialebene und Weiterentwicklung des Spindelapparates. | |
| Anaphase I | Trennung der Chromosomenpaare; Spindelfasern ziehen die homologen Chromosomen (bestehend aus jeweils zwei Chromatiden) an die diametralen Zellpole. | |
| Telophase I | Rekonstruktion des Zellkernes; Trennung (Zytokinese) der Tochterzellen (im männlichen Geschlecht obligatorisch unvollständig). | |
Ergebnis der ersten meiotischen Teilung: aus einer diploiden Zelle (2n/4C) sind zwei haploide Tochterzellen entstanden (1n/2C). Die erste meiotische Teilung ist der Schritt der Chromosomenteilung und somit die eigentliche Reduktionsteilung. Die Chromatiden sind durch den in der Prophase I erfolgten Genaustausch neu rekombiniert.
Zweite meiotische Teilung
In der zweiten meiotischen Teilung werden unmittelbar nach der ersten meiotischen Teilung die Chromatiden getrennt und auf zwei Tochterzellen aufgeteilt, sodass das Endergebnis beider meiotischen Teilungen zumindest beim männlichen Geschlecht 4 Tochterzellen mit haploidem Chromosomensatz sind. Jedes Chromosom besteht aus nur einer Chromatide (1n/1C). Der zweiten meiotische Teilung geht keine S-Phase voran. Sie ist von ihrem Ablauf her einer Mitose ähnlich.
Tab. 2
| Prophase II | Chromosomenkondensation |
| Metaphase II | Beginn der Entwicklung des Spindelapparates, Anordnung der Chromosomen in der Äquatorialebene. |
| Anaphase II | Chromatidentrennung; Aufteilung der getrennten Chromatiden auf zwei diametrale Zellpole. |
| Telophase II | Rekonstruktion des Zellkerns; Durchschnürung der Tochterzellen, wobei im männlichen Geschlecht Zytoplasmabrücken noch längere Zeit bestehen bleiben, wodurch eine synchrone Entwicklung der Tochterzellen gewährleistet wird (unvollständige Zytokinese). |
Ergebnis der zweiten meiotischen Teilung: aus einer haploiden Zelle mit 2 Chromatiden (1n/2C) sind zwei haploide Tochterzellen mit je einer Chromatide (1n/1C) entstanden!
Geschlechtsspezifische Unterschiede
Das Grundprinzip der Meiose, die Abfolge und Stadien der ersten und zweiten meiotischen Teilung, ist in beiden Geschlechtern gleich – dennoch gibt es geschlechtsspezifische Unterschiede.
Tab.3
| männlich | weiblich | |
| Beginn | Pubertät | Ende des 3. vorgeburtlichen Entwicklungsmonats |
| Ablauf | kontinuierlich | Vorgeburtlich: Prophase I bis zum Diplotän – dann Ruhephase Diktyotän Weiterführung der Meiose kurz vor Follikel-sprung (Ovarialzyklus) bis zur Metaphase II Abschluss der Meiose II nur im Fall einer Befruchtung |
| Dauer | Prophase I: 3 Wochen, die weiteren Meiosestadien nur wenige Stunden | mehrere Jahrzehnte |
| Resultat | 4 haploide befruchtungsfähige Spermatiden (1n/1C), die bis zu ihrer Entlassung aus dem Keimepithel über Zytoplasmabrücken zusammenhängen | Inäquale Aufteilung des Zytoplasmas Meiose 1: eine große Zelle, ein kleines Polkörperchen I Meiose 2: befruchtete Eizelle erhält das gesamte Zytoplasma, es entsteht ein weiteres kleines Polkörperchen II Polkörperchen I teilt sich nicht mehr, beide Polkörperchen gehen bald zugrunde |
Literatur
Lüllmann-Rauch R.: Histologie; 6. Auflage, Georg Thieme Verlag, 2019.
Weipoltshammer K. und Pusch O.: Meiose und männliche Genitalorgane; Vorlesungsunterlagen MUW-Intranet, Block 15.
Histologie der weiblichen Geschlechtsorgane
Klara Weipoltshammer, Oliver Pusch, Gerhard Viehberger
(1)Ovar (Eierstock): Produktion von Eizellen und Geschlechtshormonen
(2)Tuba uterina (Eileiter): Ort der Befruchtung, Keimtransport und Ernährung des Keims bis ca. Tag 4
(3)Uterus (Gebärmutter): Ort der Einnistung des Keims (im Regelfall)
(4)Vagina (Scheide): Kopulationsorgan und Geburtskanal
(5)Vulva (äußeres weibliches Genitale)
(6)Mamma (Brustdrüse): Milchproduktion
Das Ovar ist paarig angelegt, befindet sich an der lateralen Wand des kleinen Beckens und ist von Peritoneum überzogen.
Mikroanatomisch kann man im Ovar Rinde und Mark unterscheiden: Die Rinde besteht aus zellreichem Bindegewebe (spinozelluläres Bindegewebe), in das die Keimzellen, umhüllt von Follikelepithelzellen, eingelagert sind. Das Mark besteht aus lockerem, reichlich Blutgefäße führendem Bindegewebe.
Hauptaufgabe des Ovars ist die Produktion von für die Befruchtung bereiten Eizellen (Oogenese). Weiters fungiert das Ovar als endokrine Hormondrüse und beeinflusst eine Reihe von Stoffwechselvorgängen.
Oogenese
Schon früh in der Embryonalzeit wird das Ovar von Urkeimzellen besiedelt (siehe Vorlesung Geschlechtsentwicklung Schöfer). Die Urkeimzellen sind diploid und proliferieren durch mitotische Teilungen. Sie werden von aus dem Peritonealepithel stammenden Zellen umhüllt. Diese Hüllzellen bezeichnet man in weiterer Folge als Follikelepithel. Eine Keimzelle (Eizelle) mit den sie umgebenden Hüllzellen nennt man Follikel. Ab dem 3. Entwicklungsmonat beginnen einzelne Oogonien mit der ersten Reifeteilung, die aber nicht vollständig abläuft, sondern am Ende der Prophase I im sogenannten Diktyotän arretiert wird. Die Meiose der jetzt als Oozyte 1. Ordnung (Oozyte I) bezeichneten Keimzellen wird erst ab der Pubertät kurz vor dem Follikelsprung fortgesetzt (siehe Vorlesung Meiose Weipoltshammer, Pusch, Viehberger). Die Follikel können schon vor der Pubertät wachsen und ihr Aussehen verändern. Dabei durchlaufen sie verschiedene Stadien:
Entwicklungsstadien der Follikel
Primordialfollikel |
Die Eizelle (Stadium: Oozyte I) ist von einer Schicht flacher Follikelepithelzellen umhüllt. |
Primärfollikel |
Das Follikelepithel wird iso- bis hochprismatisch, bleibt aber einschichtig. Es wird eine Glykoproteinhülle zwischen Eizelle (Stadium: Oozyte I) und Follikelepithel abgelagert, die allmählich sichtbar wird (Zona pellucida). |
Sekundärfollikel |
Das Follikelepithel wird mehrschichtig, die Zona pellucida verdickt sich und um den Follikel bilden Zellen des Stroma ovarii eine Hülle, die Theka folliculi. |
Tertiärfollikel |
Zwischen den Zellen des Follikelepithels entsteht eine sich ständig vergrößernde flüssigkeitsgefüllte Höhle (Antrum folliculi), deren Wand von Follikelepithelzellen gebildet wird. Die Eizelle (Stadium: Oozyte I) liegt exzentrisch in einer Anhäufung von Zellen des Follikelepithels, dem Cumulus oophorus. Die Zona pellucida wird dicker. Sie wird von Mikrovilli der Eizelle und Fortsätzen der Follikelepithelzellen durchzogen. Die Theka folliculi gliedert sich in Theka interna und externa. Die Theka interna ist zusammen mit den Follikelepithelzellen für die Hormonproduktion des Ovars verantwortlich. Die Theka externa besteht aus Fibroblasten/-zyten und Myofibroblasten. |
Vor der Pubertät läuft die Follikelentwicklung nur bis zum frühen Tertiärfollikel ab. Die Gesamtzahl an Keimzellen ist während der Fetalentwicklung (5. Monat) am höchsten. Durch ständigen Untergang von Follikeln aller Stadien nimmt sie bis zur Pubertät von ca. 7 Millionen auf 400 000 ab. Größere zugrunde gegangene Follikel kann man noch einige Zeit als Narbe im Ovar erkennen (Corpus atreticum).
Ab der Pubertät bis zur Menopause entwickelt sich pro Monat im Regelfall ein Follikel zum sprungreifen Tertiärfollikel (Graaf´scher Follikel). Dieser liegt dann nahe der Ovaroberfläche. Seine dem Peritonealepithel zugekehrte Wand wird ischämisch, reißt ein und die Eizelle wird mit den sie umgebenden Follikelepithelzellen (Corona radiata) in den Eileiter abgegeben. Die Follikelhöhle füllt sich mit Blut und wird zum Corpus rubrum. Das Blutgerinnsel wird abgebaut, die Zellen der Theka interna und des Follikelepithels vermehren sich und füllen die ehemalige Follikelhöhle aus. Diese Struktur bezeichnet man als Corpus luteum. Die von den Follikelepithelzellen abstammenden Zellen nennt man Granulosa-Luteinzellen, die von der Theka interna stammenden Zellen Theka-Luteinzellen. Das Corpus luteum ist mit seiner Hormonproduktion maßgeblich für den geordneten Ablauf der 2. Zyklushälfte und bei Eintritt einer Schwangerschaft für die Aufrechterhaltung der Schwangerschaft in den ersten 3–4 Monaten verantwortlich (Corpus luteum graviditatis). Es ist als endokrine Hormondrüse reichlich kapillarisiert. Tritt keine Schwangerschaft ein, sistiert die Hormonproduktion des Corpus luteum, es vernarbt und wird dann als Corpus albicans bezeichnet. Tritt eine Schwangerschaft ein, so wird das Corpus luteum graviditatis in der zweiten Schwangerschaftshälfte ebenfalls zu einem Corpus albicans. Das Corpus albicans bleibt einige Zeit erhalten und verdämmert dann allmählich.
Hormonproduktion des Ovars
Im Follikel sind zwei Zelltypen für die Hormonproduktion verantwortlich. Die Zellen der Theka interna synthetisieren Androgene aus Cholesterin. Diese werden in den Zellen des Follikelepithels unter Einfluss der durch FSH (Follikelstimulierendes Hormon) induzierten Aromatase in Östrogene umgewandelt. Im Corpus luteum behalten die Theka-Luteinzellen als Nachfolger der Theka-interna-Zellen die Androgenproduktion bei. Die Granulosa-Luteinzellen, die den größten Teil des Corpus luteum ausmachen, produzieren hauptsächlich Progesteron (gehört zu den Gestagenen) und wenig Östrogen.
Ovarialzyklus
Die zyklische Reifung einer Eizelle steht unter hormoneller Regulation von Hypothalamus, Hypophyse und dem Ovar selbst.
| Hypothalamus | pulsförmige Ausschüttung von Gonadotropin Releasing Hormon (GnRH) |
| Hypophyse | Follikelstimulierendes Hormon (FSH) Luteinisierendes Hormon (LH) |
| Ovar (siehe oben) | Östrogene Gestagene (Progesteron) |
Knapp vor Ende des Menstruationszyklus steigert die Hypophyse ihre FSH-Produktion. Dadurch wird eine Gruppe von 10–20 Follikel (Kohorte) zu verstärktem Wachstum angeregt. Bei dem am weitesten entwickelten Follikel der Kohorte nimmt die Sensitivität der FSH-Rezeptoren zu. Er steigert seine Östrogenproduktion, wodurch die FSH-Ausschüttung der Hypophyse sinkt (negative Rückkoppelung). Gleichzeitig produziert er Inhibin. Der niedrige FSH-Spiegel in Kombination mit Inhibin führt zur Atresie der übrigen Follikel der Kohorte. Für den dominanten Follikel ist die niedrige FSH-Konzentration dank seiner erhöhten Sensitivität für FSH zur weiteren Entwicklung ausreichend.
Die starke Erhöhung des Östrogen-Spiegels führt zu einer LH-Ausschüttung in der Hypophyse. Dadurch wird die Östrogenbildung gedrosselt. Im dominanten Follikel wird durch den LH-Anstieg kurz vor dem Follikelsprung die Fortsetzung der Meiose induziert. Es kommt zur Ovulation, und die Eizelle wird in die Tube abgegeben. Im Ovar kommt es zur Bildung des Corpus luteum. Die Gestagenproduktion nimmt stark zu, die Östrogenproduktion weniger stark. Der hohe Progesteron-Spiegel führt zu einem Absinken der LH-Produktion (negative Rückkoppelung). Da die Gestagenbildung LH-abhängig ist, sinkt sie allmählich ab. Gleichzeitig sinkt die Östrogenproduktion, und somit kann wieder FSH von der Hypophyse gebildet werden und eine neue Follikelkohorte rekrutiert werden.
Die Tube stellt die Verbindung zwischen Ovar und Uterus dar. Auf der Seite des Ovars ist sie zur Bauchhöhle hin offen. An diesem Ende ist sie trichterförmig erweitert und hat Fransen (Fimbrien), mit denen sie dem Ovar aufliegt, um das Ei nach dem Follikelsprung aufzufangen. Das andere Ende mündet in den Uterus. Anatomisch kann man vier Abschnitte unterscheiden. Das Infundibulum ist der trichterförmige Teil der Tube, der die Eizelle aufnimmt. Die Ampulle ist der längste Teil der Tube. Hier findet üblicherweise die Befruchtung statt. Der Isthmus ist eine kurze Engstelle vor der Uteruswand. Die Pars uterina ist jener Teil, der durch die Uteruswand durchtritt.
Die Wand der Tube besteht aus folgenden Schichten: Tunica mucosa; Tunica muscularis propria; Tela subserosa; Tela serosa.
Die Schleimhaut (Tunica mucosa) ist gefaltet. Sie besitzt ein einschichtig hochprismatisches Epithel (Lamina epithelialis). Das auf einer Basallamina aufliegende Epithel setzt sich aus Flimmerzellen und Drüsenzellen zusammen. Apoptotische Zellen treten als Stiftchenzellen zutage. Unter der Lamina epithelialis liegt das Bindegewebe der Lamina propria.
Die Tunica muscularis propria besteht aus glatter Muskulatur und hat einen inneren, zirkulär verlaufenden, und einen äußeren, längs verlaufenden Anteil.
Die Tela subserosa besteht aus lockerem Bindegewebe mit einer eingelagerten glatten Muskelschicht (subseröse Muskulatur).
Die Tela serosa stellt den Bauchfellüberzug der Tube dar. Sie setzt sich aus einem einschichtig platten Epithel und einer dünnen Bindegewebsschicht zusammen.
In der Pars ampullaris der Tube findet die Befruchtung statt. Die Tube dient somit dem Transport der Eizelle bzw. des Keims sowie auch der Ernährung des Keims (Tubensekret) bis zum Tag 4.
Nach abgelaufenen Entzündungen können die Falten der Schleimhaut verkleben, was einen partiellen oder vollständigen Verschluss der Tube bedingen kann. Ein partieller Tubenverschluss stellt ein erhöhtes Risiko für eine Eileiterschwangerschaft (Einnistung des Keims in der Tubenwand) dar.
Der Uterus, im Regelfall Ort der Einnistung und Reifung des Keims, liegt zwischen Rektum und Harnblase. Er ist im vorderen, oberen und hinteren Bereich von Peritoneum bedeckt. Kranial münden die beiden Tuben in den Uterus, kaudal führt die Vagina weiter. Der Uterus besteht anatomisch aus dem Corpus uteri, der Zervix uteri und der Portio vaginalis. Die Portio vaginalis ragt in das kraniale Ende der Vagina.
Der Uterus besteht aus folgenden Schichten: Tunica mucosa (Endometrium), Tunica muscularis propria (Myometrium) und Tunica adventitia (Parametrium) bzw. Tunica subserosa/serosa (Perimetrium).
Tunica mucosa: Das Endometrium besteht aus einer einschichtig hochprismatischen Lamina epithelialis mit Flimmerzellen, Drüsenzellen und Stiftchenzellen und einer bindegewebigen Lamina propria. Die Lamina epithelialis senkt sich in die Tiefe und bildet die Uterusdrüsen aus.
Im Corpus uteri ist die Dicke der Tunica mucosa sowie die Ausformung der Drüsenschläuche abhängig vom Ovarialzyklus.
Tunica muscularis propria: Beim Myometrium handelt es sich um eine Schicht glatter Muskulatur, deren Masse bei Bedarf (Schwangerschaft) durch Zellvermehrung (Hyperplasie) und Zellwachstum (Hypertrophie) stark zunehmen kann. Die Muskulatur wird von Bindegewebe durchzogen, das Gefäße beinhaltet.
Tunica adventitia: Mit dem lockeren Bindegewebe des Parametrium ist der Uterus in der Umgebung verankert. Im Bereich der Vorder- und Hinterfläche sowie am Uterusscheitel finden wir eine Tela subserosa (lockeres Bindegewebe) und einen Peritonealüberzug (Tela serosa).
Zyklische Veränderungen der Uterusschleimhaut
Zyklusabhängig können am Endometrium drei Phasen unterschieden werden:
Die Proliferationsphase erstreckt sich vom Ende der Menstruationsblutung (Tag 4) bis zum Tag 14 des Zyklus. Das nach der Desquamation (siehe unten) zurückbleibende Endometrium (= Zona basalis) proliferiert. Das Epithel deckt die durch die Menstruation entstandene Wunde ab. Die neu gebildete, immer dicker werdende Schicht des Endometriums nennt man Zona functionalis. Die Drüsenschläuche verlaufen zunächst gerade, später sind sie korkenzieherartig gewunden. Die rasche Dickenzunahme des Endometriums wird durch den zunehmenden Östrogenspiegel in der ersten Zyklushälfte verursacht (siehe Ovar).
Von Tag 15 bis zu Tag 28 erstreckt sich die Sekretionsphase. Sie steht unter dem Einfluss des Progesterons. Die Drüsenschläuche werden sägeblattartig gezackt. Mit ihrem Sekret (Glykoproteine, Lipide etc.) sind sie in der Lage, den Keim kurzfristig zu ernähren. In die Bindegewebszellen der Lamina propria lagern sich Glykogen und Lipide ein (Prädeziduazellen). Auch sie dienen der Ernährung des Keims. Am Ende der Sekretionsphase wird die Schleimhaut ischämisch (Konstriktion der zuführenden Gefäße), was zur Schädigung des Gewebes führt. Bei Wiedereröffnung der Gefäße zerreißen diese, und es kommt zur Menstruationsblutung.
In der Desquamationsphase (Tag 1–3) wird die Schleimhaut mit Ausnahme der Zona basalis abgestoßen.
Mit der Engstelle des Isthmus uteri (Gefäßarmut – Zugang beim Kaiserschnitt) geht der Corpus uteri in die Zervix über. Die Zervix besteht aus der Portio supravaginalis cervicis und aus der in die Vagina ragenden Portio vaginalis cervicis. Sie verschließt den Uterus gegenüber der Vagina. Die Epithelzellen der Zervix sind ebenfalls hochprismatisch, aber mit basal liegendem Zellkern und hellem Zytoplasma. Zyklusbedingt gibt es im Isthmusbereich schwache, in der Zervix kaum Veränderungen. Die Grenze zwischen Zylinderepithel (Zervix) und mehrschichtig unverhorntem Plattenepithel (Vagina) verläuft vor der Pubertät am Beginn des Zervikalkanals, nach der Pubertät auf der der Vagina zugekehrten Seite der Portio.
Beim PAP-Abstrich (Papanicolaou-Test) wird Material von Portio, Zervikalkanal und Vagina entnommen. Der Abstrich wird nach Papanicolaou gefärbt (Glykogen: rot, Zellkerne: blau, Zytoplasma: grünblau). Im normalen Abstrich sollten nur Zellen der oberen Schichten des Plattenepithels (Superfizial- und Intermediärzellen) und Zellen des Zervikalkanals enthalten sein. Je oberflächlicher eine Zelle gelegen ist, desto höher ist ihr Glykogengehalt. Ihr Zellkörper färbt sich daher intensiv rot. Weiters findet man immer wieder Abwehrzellen (Granulozyten) und Bakterien (physiologisch: Döderlein’sche Stäbchen, wandeln Glykogen zu Milchsäure um).
Die Vagina stellt die Verbindung zur Außenwelt dar. Ihre Wandschichten sind eine Tunica mucosa, eine Tunica muscularis propria und eine Tunica adventitia. Das Epithel der Vagina ist ein mehrschichtig unverhorntes Plattenepithel. Man unterscheidet hier ein Stratum basale, parabasale, intermedium und ein Stratum superficiale. Je höher die Epithelzellen im Epithel liegen, desto mehr Glykogen lagern sie ein. Das durch die abschilfernden Superfizialzellen freigesetzte Glykogen wird von den Döderlein’schen Stäbchenbakterien als Substrat verwendet und in Milchsäure verwandelt. Dadurch entsteht in der Vagina ein saures Milieu, was der Besiedlung mit pathogenen Keimen entgegenwirkt. Unter dem Epithel befindet sich eine Lamina propria, die einen Venenplexus enthält. Die Tunica muscularis propria besteht aus glatter Muskulatur und ist dünn.
Die Vagina ist Kopulationsorgan und Geburtskanal.
5 Äußeres weibliches Genitale (Vulva)
Das äußere weibliche Genitale besteht aus Clitoris, Labia maiora, Labia minora und Vestibulum vaginae (umfasst Mündung von Vagina und Urethra).
Die Clitoris enthält einen Schwellkörper. Dieser ist dem Corpus cavernosum penis homolog. Die Labia maiora sind von mehrschichtig verhorntem Plattenepithel bedeckt. Auf der Außenseite sind sie behaart, innen unbehaart. Hier kommen alle drei Typen der Haut assoziierten Drüsen vor: ekkrine Schweißdrüsen, apokrine Duftdrüsen und holokrine Talgdrüsen. Die Labia maiora enthalten glatte Muskulatur und Fettgewebe. Die Labia minora sind ebenfalls von mehrschichtigem Plattenepithel bedeckt. Allerdings ist dieses nur an der Außenseite verhornt, an der Innenseite geht es in unverhorntes Plattenepithel über. Hier kommen keine Haare, aber viele freie Talgdrüsen vor. Die Labia minora enthalten einen Schwellkörper, der dem Corpus spongiosum penis homolog ist. In das Vestibulum vaginae münden zwei schleimproduzierende Drüsen. Die Glandulae vestibulares minores entsprechen den Glandulae urethrales des Mannes. Die Glandulae vestibulares maiores (Bartholin-Drüsen) sind tubulo-alveolär und entsprechen den Bulbourethraldrüsen beim Mann.
Die Mamma ist eine bei beiden Geschlechtern paarig angelegte Drüse, die beim Mann im Normalfall rudimentär bleibt (hemmende Wirkung der männlichen Sexualhormone). Sie besteht aus 10–20 einzelnen Drüsenanlagen mit Mündung des Ausführungsgangs auf der Brustwarze (Mamilla). Das Organ ist in Binde- und Fettgewebe eingebettet.
Beim weiblichen Geschlecht kommt es ab der Pubertät unter Einfluss der weiblichen Sexualhormone zur Proliferation der Milchgänge und Ausbildung rudimentärer, noch nicht funktionsfähiger Endstücke. Auch das Stroma nimmt zu.
Mamma non lactans
Die weibliche Brustdrüse besteht aus folgenden Abschnitten:
Endstücke der einzelnen Drüsen, durch das bindegewebige Stroma in Läppchen (Lobuli) unterteilt; Endstücke sind rudimentär
Ausführungssystem:
Ductus lactiferi: 2-schichtig kubisches Epithel, Lage: im Bindegewebe zwischen den Lobuli
Sinus lactiferi: 1-schichtig hochprismatisches Epithel, Lage: unterhalb der Mamille
Ausführungsgänge: mehrschichtig unverhorntes Plattenepithel, Mündung an der Mamille
In der nicht laktierenden Brust überwiegen Binde- und Fettgewebe.
Mamma lactans
Während der Schwangerschaft beginnen die Endstücke auszusprossen, sich zu vermehren und sich zu voll ausgebildeten Endstücken zu entwickeln. Östrogene, Progesteron und Prolaktine haben auf Proliferation und Differenzierung der Endstücke Einfluss.
Im Gegensatz zur nicht laktierenden Mamma überwiegt hier das Drüsengewebe. Das Bindegewebe wird durch die Drüsenläppchen mit ihren stark ausgeweiteten Endstücken verdrängt. Es bildet zwischen den Läppchen schmale Septen (straffes Bindegewebe). Zwischen den Endstücken und direkt um das Gangsystem findet man lockeres Bindegewebe. Die Endstücke sind einschichtig und haben außen Myoepithelialzellen angelagert. Diese sind für den Weitertransport des Sekrets zuständig. Die Mamma ist eine apokrine Drüse (Milchkügelchen – Lipide). Andere Substanzen (z. B. Proteine) werden ekkrin sezerniert.
In den Tagen nach der Geburt wird die Milchsekretion unter Einfluss des Prolaktins hochgefahren. Die sekretionshemmende Wirkung des Progesterons fällt mit der Geburt weg. Die Milchausschüttung wird über das Saugen des Kindes an der Brust und die darauffolgende Oxytocinausschüttung eingeleitet.
Zusammensetzung der Muttermilch: |
Proteine: 1 % |
Wasser: 88 % |
Fett: 4 % |
Ionen (Phosphat, Jod, Kalzium) |
|
Laktose: 7 % |
Immunglobuline (IgA) |
Literatur
Lüllmann-Rauch R.: Histologie; 2. Aufl.; Georg Thieme Verlag, 2006.
Wachtler F. (Hg.): Histologie; 7., verb. Auflage; Facultas, 2005.
Weipoltshammer K.: Praktikumsunterlage Histologie – Weibliches Genitale; MUW-Intranet, Block 15.
Weipoltshammer K. und Viehberger G.: Histologie: Meiose und männliche Genitalorgane; Vorlesungsunterlagen MUW-Intranet, Block 15.
Weipoltshammer K. und Viehberger G.: Histologie: weibliche Genitalorgane; Vorlesungsunterlagen MUWIntranet, Block 15.
Histologie der männlichen Geschlechtsorgane
Klara Weipoltshammer, Oliver Pusch, Gerhard Viehberger
(1)Testis (Hoden): Produktion von Samenzellen, Sekret und männlichen Geschlechtshormonen; morphologische Reifung der Samenzellen; Beginn der ableitenden Samenwege
(2)Epididymis (Nebenhoden): physiologische Reifung der Spermien, Sekretion und Rückresorption, Spermientransport und Speicherung
(3)Ductus deferens (Samenleiter) und Ductus ejaculatorius: Spermientransport
(4)Akzessorische Geschlechtsdrüsen: Sekretproduktion
Glandula vesiculosa (Bläschendrüse, Samenbläschen) Prostata (Vorsteherdrüse)
Glandula bulbourethralis (Cowper’sche Drüse)
Glandula urethralis bzw. paraurethralis (Littré’sche Drüse)
(5)Äußeres männliches Genitale:
Penis: Kopulations- und Ausscheidungsorgan Skrotum (Hodensack): Temperaturregelung
Die paarigen Hoden (Testes) entwickeln sich ab der 5. Embryonalwoche aus den in der Bauchhöhle gelegenen Genitalleisten (Gonadenleisten) und werden noch während der Fetalzeit in den Hodensack (Skrotum) verlagert (Descensus testis; wichtig, da die Hodentemperatur für die normale Keimzellentwicklung etwa 2 °C unter der intra-abdominalen Temperatur liegen muss; siehe auch Thema “Die Geschlechtsentwicklung“). Sie liegen in einer ursprünglich aus einer Duplikatur des Peritoneums entstandenen Hülle, der Tunica vaginalis testis. Das äußere Blatt dieser Duplikatur wird als Periorchium bezeichnet. Das innere Blatt, das Epiorchium, liegt dem Hoden (und teilweise auch dem Nebenhoden) direkt auf und ist mit dessen Tunica albuginea (Begriffserklärung: siehe unten) verwachsen. Sowohl Epi- als auch Periorchium bestehen aus einem einschichtig platten Epithel (Mesothel) und einer darunter liegenden Bindegewebsschichte. Die beiden Epithelschichten begrenzen einen von seröser Flüssigkeit erfüllten Spaltraum, das Cavum serosum testis. Der Tunica vaginalis testis liegt der quergestreifte Musculus cremaster außen auf. Über das Mediastinum testis, einem gefäßreichen Bindegewebe, ist der Hoden an das Gefäßsystem und die ableitenden Samenwege angeschlossen.
Den Hoden selbst umgibt eine aus straffem, kollagenem Bindegewebe bestehende Kapsel, die Tunica albuginea. In diese sind Myofibroblasten, glatte Muskelzellen und vereinzelt elastische Fasern eingelagert. Vom Mediastinum testis ziehen bindegewebige Septen, die Septula testis, in das Hodeninnere, das durch diese Septen in etwa 370 einzelne Lobuli testis unterteilt wird. Diese Läppchen beinhalten das Hodenparenchym: die Spermien produzierenden Samenkanälchen (Hodenkanälchen) und die zwischen den Hodenkanälchen liegenden, Testosteron synthetisierenden Leydig’schen Zwischenzellen, beide eingebettet in lockeres, gefäßreiches Bindegewebe.
Samenkanälchen: Tubuli seminiferi (contorti)
In den Samenkanälchen erfolgen die genetische und die morphologische Keimzellreifung. Die Tubuli seminiferi sind etwa 20–50 cm lang und zum größten Teil sehr stark aufgeknäuelt (= „contorti“). Nur ihre kurzen Endstücke, über welche sie Anschluss an das Rete testis finden, verlaufen gestreckt (= „recti“). Die Keimzellreifung findet hauptsächlich in den Tubuli seminiferi contorti statt, kann aber vereinzelt auch noch am Beginn der Tubuli recti beobachtet werden. Dieser Übergang wird von manchen Autoren auch als „Terminalsegment“ bezeichnet.
Die Hodenkanälchen (Tubuli seminiferi contorti und Tubuli recti) werden von einer dünnen Lamina propria umhüllt. In das Bindegewebe der Lamina propria sind Myofibroblasten (kontraktile Bindegewebszellen) eingelagert, durch deren Kontraktionswellen die im Hoden noch bewegungsunfähigen Spermatozoen in das Rete testis und den angrenzenden Nebenhoden transportiert werden. Das Rete testis liegt am Übergang zu den samenableitenden Wegen im Mediastinum testis.
Die Hodenkanälchen selbst sind epithelial ausgekleidet. Im gesamten Verlauf der Tubuli seminiferi contorti findet man einen speziellen Epitheltypus, das Keimepithel.
Das Keimepithel besteht aus zwei unterschiedlichen Zellpopulationen: den somatischen Epithelzellen (Sertoli-Zellen) und den Keimzellen.
Die der Basallamina aufsitzenden, hochprismatischen (Höhe: etwa 80 μm) Sertoli-Zellen sind im Lichtmikroskop an ihrem typischen Zellkern (längsoval, unregelmäßige Außenkontur, lockeres Chromatin, deutlich sichtbarer Nukleolus) eindeutig erkennbar. Zwischen den Sertoli-Zellen liegen die Keimzellen, je weiter entwickelt, desto höher im Epithel. Relativ basal, oberhalb der Spermatogonien, sind die Sertoli-Zellen durch zahlreiche Tight junctions verbunden, wodurch eine immunologische Schranke und Stoffwechselbarriere, die Blut-Hoden-Schranke, entsteht. Die Blut-Hodenschranke schafft im Keimepithel zwei getrennte Räume: das basale und das adluminale Kompartiment. Das basale Kompartiment, in welches die Spermatogonien eingelagert sind, wird durch Diffusion aus dem Blutgefäßsystem versorgt; im adluminalen Kompartiment, in dem Meiose und Differenzierung der Keimzellen stattfinden, herrscht ein völlig anderes Mikromilieu, das von den Sertoli-Zellen geschaffen wird. Die Sertoli-Zellen versorgen die im adluminalen Kompartiment gelegenen Keimzellen mit Nährstoffen, sezernieren ein proteinreiches Sekret, in das die Spermien freigesetzt werden, und schirmen sie teilweise vor Schadstoffen ab. Eine Störung der Blut-Hoden-Schranke führt unweigerlich zu einer Störung der Spermatogenese.
Die zweite Komponente des Keimepithels sind die zwischen den Sertoli-Zellen eingelagerten Keimzellen, die die Spermatogenese durchlaufen.
Der Vorgang der Spermatogenese beinhaltet Vermehrung der Spermatogonien, Reifung der Spermatozyten (Meiose) und Differenzierung der Spermatozoen (Spermiogenese). Auf die Reifung der Spermatozyten wurde schon eingegangen (Thema „Meiose“).
Entwicklungsstadien der männlichen Keimzellen
■Spermatogonien A: liegen zwischen Sertoli-Zellen im basalen Tubuluskompartiment, sorgen durch mitotische Teilungen für einen permanenten Vorrat an Keimzellen (pränatal und ab der Pubertät lebenslang)
■Spermatogonien B: gehen aus Spermatogonien A hervor, machen noch einige mitotische Teilungen durch, durchwandern dann die Blut-Hoden-Schranke und treten im adluminalen Kompartiment in die meiotische Prophase I ein. Ihre Entwicklung beginnt mit dem Eintritt in die Pubertät. Die aus der Teilung einer A-Spermatogonie hervorgegangenen B-Spermatogonien bleiben über Zytoplasmabrücken verbunden (unvollständige Zytokinese) und machen alle Entwicklungsschritte synchron durch (Klon).
■Spermatozyten I: durchlaufen die Meiose I
■Spermatozyten II: durchlaufen die Meiose II
■Spermatiden: haben die Meiose bereits abgeschlossen und treten in die Differenzierung zum reifen Spermatozoon (Spermiogenese) ein. Frühe Spermatiden sind kleine, lumenwärts im Hodentubulus gelegene Zellen mit runden Zellkernen, die in apikalen, taschenförmigen Einsenkungen der Sertoli-Zellen liegen. Folgende Umformungen zu einer bewegungsfähigen Samenzelle sind notwendig: Das Chromatin wird durch den Austausch somatischer Histone gegen Protamine kleinstmöglich kondensiert, die Kernform wird elongiert. Um das Vorderende des Zellkernes entsteht aus Golgi-Vesikeln das Akrosom (enthält lytische Enzyme, die zum Eindringen des Spermiums in die Eizelle benötigt werden). Am kaudalen Pol des Spermienkopfes entwickelt sich aus dem Zentriol das Flagellum, das dem späteren Spermium die Beweglichkeit verleiht. Es besteht aus Halsstück, Mittelstück, Hauptstück und Endstück. Um das Mittelstück ordnen sich konzentrisch Mitochondrien an. Der Großteil des Zytoplasmas der Spermatide wird als „residual body“ von der Sertoli-Zelle resorbiert. Die morphologisch ausgereifte späte Spermatide wird mit der Entlassung aus der Bucht der Sertoli-Zelle, der Spermiation, zum Spermatozoon. Erst bei der Spermiation werden die Zytoplasmabrücken zwischen den Spermatiden eines Klons aufgelöst.
■Spermatozoon: morphologisch ausdifferenzierte Samenzelle nach ihrer Freisetzung in das Tubuluslumen. Spermatozoen sind noch nicht befruchtungsfähig und reifen erst im Nebenhoden physiologisch aus. Sie sind durch das in den Tubuli seminiferi herrschende saure Milieu bewegungsunfähig und werden durch Kontraktion der die Tubuli umgebenden Myofibroblasten weiter transportiert. Spermatozoen werden in ungeheuren Mengen produziert (normal sind > 15 Mio. Spermien pro ml Ejakulat).
Die Spermatogenese ist ein hormonabhängiger Vorgang, gesteuert über das Hypothalamus-Hypophysen-System und dessen im Testis gelegenen Effektor-Zellen (Leydig´sche Zwischenzellen, Sertoli-Zellen, siehe Thema „Endokrinium des Mannes“).
Leydig-Zellen liegen meist in Gruppen zwischen den Hodenkanälchen. Sie produzieren Androgene, insbesondere Testosteron, aber auch (Neuro-)Peptide, über die sie die Durchblutung und die Spermatogenese beeinflussen. Ihre Morphologie weist für Steroid-produzierende Zellen typische Merkmale auf: einen lockeren, hochaktiven Zellkern mit deutlichen Nukleolen, ein schaumig aussehendes, azidophiles Zytoplasma; elektronenoptisch findet man im Zytoplasma reichlich glattes Endoplasmatisches Retikulum, zahlreiche Lipidtröpfchen und tubuläre Mitochondrien.
Die Tubuli seminiferi contorti gehen in die Tubuli recti über. Hier findet nur mehr vereinzelt Samenproduktion statt. Zusammen mit dem darauffolgenden Rete testis stellen sie einen Übergang zu den samenableitenden Wegen dar. Die Tubuli recti weisen zunächst noch ein einschichtighochprismatischen Epithel auf, das Rete-wärts in seiner Höhe abnimmt. Das Rete testis besteht aus anastomosierenden spaltförmigen Hohlräumen, die von einschichtig plattem bis isoprismatischem Epithel ausgekleidet sind. Die Epithelzellen der Tubuli recti und des Rete testis geben eine proteinreiche Flüssigkeit ab, in der die noch unbeweglichen Spermien schwimmen. Vom Rete testis führen die Ductuli efferentes in den Nebenhoden.
Der Nebenhoden liegt dem Hoden lateral im Bereich des Rete testis auf und besteht aus Kopf (Caput epididymidis), Körper (Corpus epididymidis) und Schwanz (Cauda epididymidis). Auch die ableitenden Samenwege des Nebenhodens lassen sich in drei Abschnitte gliedern: die Ductuli efferentes, der Ductus epididymidis und der Beginn des Ductus deferens. Sie sind in Bindegewebe eingebettet. Außen ist der Nebenhoden von einer dünnen, bindegewebigen Kapsel begrenzt. Das Caput ist zusätzlich in die Tunica vaginalis testis einbezogen.
Ductuli efferentes: Das Rete testis am Übergang von Hoden zu Nebenhoden mündet in etwa 12 Ductuli efferentes, die im Caput epididymidis in den Ductus epididymidis münden. Die Lamina epithelialis ist ein- bis mehrreihig und beinhaltet iso- bis hochprismatische Zellen. Darunter befindet sich Bindegewebe, das auch kontraktilen Zellen (vorwiegend Myofibroblasten, vereinzelt glatte Muskelzellen; dienen dem Spermientransport) beinhaltet. Das Epithel setzt sich aus zwei Zelltypen zusammen: Hauptzellen und Flimmerzellen.
■Hauptzellen: isoprismatische, meist in einschichtigen Gruppen liegende Zellen mit Mikrovilli, die etwa 90 % der im Hoden produzierten Flüssigkeit resorbieren.
■Flimmerzellen: hochprismatische, in Gruppen zwischen Hauptzellen liegende Zellen mit Kinozilien (in diesen Bereichen ist das Epithel oft mehrreihig), die zum Spermientransport beitragen.
Die unterschiedliche Höhe der Epithelzellen, aber auch die unterschiedliche Reihigkeit des Epithels resultiert in einer wellenförmig erscheinenden inneren Oberfläche der Ductuli efferentes. Die Ductuli efferentes münden in einen gemeinsamen, ableitenden Kanal, den Nebenhodengang
Ductus epididymidis, der den Hauptanteil des Nebenhodens ausmacht.
Ductus epididymidis: Der Ductus epididymidis hat eine Länge von 5–6 m. Er beginnt im Caput, macht den Hauptteil des Corpusbereiches aus und setzt sich in der Cauda fort, wo er in den Ductus deferens übergeht. Seine Wand besteht aus einer Lamina epithelialis und einer Schicht kontraktiler Zellen, wobei der Anteil an Myofibroblasten caudawärts abnimmt, im Gegenzug der Anteil an glatten Muskelzellen stark zunimmt, und somit die Muskelschicht caudawärts dicker wird. Das Epithel ist im gesamten Verlauf zweireihig hochprismatisch, wodurch die innere Oberfläche des Ductus epididymidis glattrandig erscheint. Es besteht aus Hauptzellen und Basalzellen.
■Hauptzellen: hochprismatische Zellen mit Stereozilien (langen, unbeweglichen Fortsätzen), die sowohl resorbieren (weitere Resorption der aus dem Hoden und dem Rete testis stammenden Flüssigkeit) als auch sezernieren (Glykoproteine, Glycerylphosphorylcholin, Carnitin, Sialinsäure, Enzyme, geringe Mengen an Testosteron und Dehydroepiandrosteron u.a.). Sie sind für die endgültige physiologische Reifung der Spermien verantwortlich, die diese während des langsamen Transports durch den Ductus epididymidis erreichen. Die Hauptzellen produzieren Mikrovesikel (Epididymosomen), von denen aus wesentliche Moleküle auf die Oberflächenmembran der Spermatozoen übertragen werden. Durch das saure Milieu (pH um 6,5) bleiben die Spermien in ihrer Beweglichkeit gehemmt.
■Basalzellen: isoprismatisch mit kugeligem Zellkern; Ersatzzellen, die sich zu Hauptzellen differenzieren.
Im Ductus epididymidis erhalten die Spermien ihre physiologische Reife, und im erweiterten Ende des Ductus epididymidis, dem Rezeptakulum, werden sie oft über mehrere Tage gespeichert, bevor sie ihren Weg in den Samenleiter, den Ductus deferens, fortsetzen.
3 Samenleiter (Ductus deferens)
Der Ductus deferens beginnt im Bereich der Cauda epididymidis, verlässt dann den Nebenhoden, zieht durch den Leistenkanal in das kleine Becken und erweitert sich kurz vor Erreichen der Prostata zur Ampulla ductus deferentis. Danach verengt er sich wieder, zieht durch die Prostata, wo er Ductus ejaculatorius genannt wird, und mündet am Colliculus seminalis in die Urethra (Harnröhre). Ab hier sind samen- und harnführendes System ident. Der Ductus deferens wird von funktionell wichtigen Strukturen begleitet: Aa testiculares, A. ductus deferentis, Plexus pampiniformis (Venenplexus – Venen mit weitem Lumen und dicker Muskulatur), Lymphgefäße, Nerven. Der M. cremaster und das umhüllende Bindegewebe sind entwicklungsmäßig Abkömmlinge der Schichten der Bauchwand. In seiner Gesamtheit wird dieser Strang als Samenstrang (Funiculus spermaticus) bezeichnet.
Die Wand des Ductus deferens besteht aus einer Tunica mucosa und einer im Verlauf an Stärke zunehmenden Tunica muscularis. Die Tunica mucosa gliedert sich in Lamina epithelialis und Lamina propria. Die Lamina epithelialis ist zwei- bis mehrreihigen, hochprismatisch. Die Epithelzellen tragen am Beginn noch deutlich ausgeprägte Stereozilien (vgl. Ductus epididymidis), die allmählich kürzer und weniger zahlreich werden und schließlich gänzlich verschwinden. Die Lamina propria ist eine zarte Bindegewebsschicht mit elastischen Fasern. Die Tunica muscularis besteht aus glatten, spiralig angeordneten Muskelzellen, die innen vorzugsweise längs-, in der Mitte zirkulärund außen wieder längsorientiert verlaufen. Die Muskulatur des Ductus deferens ist besonders dicht innerviert. Sie befördert die Spermien mittels (durch neuronale Stimulation ausgelöste) Kontraktionswellen rasch vom Nebenhoden in die Urethra. Die eigentliche Ejakulation aus der Urethra erfolgt durch Kontraktion von Muskeln des Diaphragmas urogenitalis.
4 Akzessorische Geschlechtsdrüsen
Zu den akzessorischen Geschlechtsdrüsen gehören die Bläschendrüsen (Glandulae vesiculosae), die Vorsteherdrüse (Prostata), die Cowper’schen Drüsen (Glandulae bulbourethrales) und die Littré’schen Drüsen (Glandulae urethrales bzw. paraurethrales).
Glandula vesiculosa (auch Samenblase – Vesicula seminalis): Die Glandula vesiculosa ist paarig angelegt und entsteht aus einer lateralen Aussackung des Ductus deferens auf Höhe der Ampulla ductus deferentis. Sie besteht aus einem 15 cm langen, stark gefalteten Schlauch (tubulöse Drüse), der in Bindegewebe eingebettet ist. Die Drüse wird von einer bindegewebigen Kapsel umgeben. Die Tunica mucosa ist stark gefaltet („Schleimhautbrücken“) und weist eine einschichtige bis zweireihige, iso- bis hochprismatische Lamina epithelialis und eine zarten Lamina propria auf. Auf die Lamina propria folgt eine Tunica muscularis aus glatten Muskelzellen. Die Drüsenzellen geben ein visköses, Fruktose- und Glucose-reiches, schwach alkalisches (pH 7,2–7,4) Sekret ab, das auch Prostaglandine und Proteine (wie z. B. Semenogelin – bewirkt das Gelieren des Ejakulats) enthält. Das Sekret der beiden Glandulae vesiculosae ist der Hauptbestandteil des Ejakulats (50–80%). Die pH-Wert-Änderung der Samenflüssigkeit von sauer zu alkalisch bewirkt die Aktivierung der Motilität der Spermatozoen; Fruktose und Glucose liefern die Energie für die Spermienbeweglichkeit. Die Aktivität der Glandula vesiculosa ist testosteronabhängig.
Prostata: Die Prostata liegt zwischen Harnblase und Diaphragma urogenitale. Sie umgreift den Harnblasenhals und die abgehende Harnröhre (Pars prostatica urethrae), und wird von den beiden Ductus ejaculatorii durchzogen, die im Bereich der Prostata in die Urethra einmünden. Die Prostata ist histologisch (nach McNeal) in folgende Regionen gegliedert: anteriomediale drüsenfreie Zone, dann von innen beginnend: periurethrale Zone, zentrale Zone und periphere Zone, weiters im proximalen Drüsenbereich die Transitionszone (Übergangszone lateral der Urethra zwischen periurethraler Zone und Außenzone). Diese Zonierung ist in der Pathologie von Bedeutung, da sich das Prostata-Karzinom vorwiegend in der Außenzone der Drüse manifestiert. Die Prostata besteht aus 25–50 tubulo-alveolären Drüsenschläuchen. Diese werden von einer derben fibromuskulären Kapsel umhüllt. Die Kapsel ist nicht dehnbar, was in Problemen bei der Miktion im Falle einer Volumsvermehrung der Drüse resultiert. Die Drüsenschläuche münden mit 15–30 Ausführungsgängen (Ductuli prostatici) in die Pars prostatica urethrae. Sie haben ein einschichtiges bis mehrreihiges, meist zweireihiges, iso- bis hochprismatisches Epithel, das aus Drüsenzellen, Basalzellen und in geringer Zahl auch aus endokrinen Zellen besteht. Außen folgt eine Wand aus Bindegewebe und glatter Muskulatur, deren Kontraktion dem Auspressen des Sekrets dient. Zwischen den Drüsenschläuchen liegt gefäßführendes Bindegewebe. Das von den Drüsenzellen produzierte, dünnflüssige Sekret kann sich zu sogen. „Prostatasteinen“ verfestigen, die mit zunehmendem Alter vermehrt auftreten. Es enthält neben Zink, Zitronensäure, Spermin, Spermidin u. a. auch prostataspezifische saure Phosphatase und prostataspezifisches Antigen (PSA). Die beiden Letztgenannten haben diagnostische Bedeutung, da sie bei Entartungen der Prostata in erhöhtem Ausmaß im Blut festgestellt werden können. PSA ist für die Verflüssigung des viskösen Sekrets der Glandula vesiculosa verantwortlich. Mit einem pH-Wert von 6,4 ist das Sekret schwach sauer, würde also spermienlähmend wirken. Da der Anteil am Gesamtejakulat mit 25–30 % jedoch geringer ist als der des Sekrets der Glandula vesiculosa, bleibt der pH-Wert des Ejakulats (pH um 7,2) im schwach alkalischen Bereich und somit die Motilität der Spermien gewährleistet. Wachstum und Aktivität der Prostata sind Dihydrotestosteron-abhängig (siehe Themen „Die Geschlechtsentwicklung“, „Biochemie der Sexualhormone“ und „Therapeutische Anwendung von Sexualsteroiden“).
Die Anhangdrüsen der Urethra, die Cowper’schen Drüsen (Glandulae bulbourethrales) und die Littré’schen Drüsen (Glandulae urethrales bzw. paraurethrales), sind kaum an der Bildung des Ejakulats beteiligt. Diese Drüsen sind für die Produktion des sogen. „Vorsafts“, der in Form von wenigen, klar erscheinenden Tröpfchen vor der eigentlichen Ejakulation aus der Urethra austritt, verantwortlich.
Glandula bulbouretralis: Die paarig angelegten Glandulae bulbouretrales liegen im Diaphragma urogenitale. Sie sind tubulöse verzweigte Drüsen. Ihr Epithel ist einschichtig hochprismatisch mit basal liegenden Zellkernen. Ihre beiden Ausführungsgänge münden in den erweiterten Anfangsteil der Pars spongiosa urethrae. Sie produzieren dünnflüssiges, muköses Sekret.
Glandula urethralis (paraurethralis): Die Glandulae urethrales (paraurethrales) liegen in Mehrzahl entlang der Pars spongiosa urethrae sowohl intraepithelial als auch abgesetzt im Bindegewebe der Urethra und bisweilen sogar im Corpus spongiosum (siehe Kapitel Penis). Es handelt sich um tubulöse muköse Drüsen.
Zum äußeren männlichen Genitale gehören das männliche Glied (Penis) und der Hodensack (Skrotum).
Penis: Der Penis ist sowohl Ausscheidungs- als auch Kopulationsorgan. Er führt die Harnröhre (Urethra pars spongiosa), und verfügt über ein System von Schwellkörpern (Corpora cavernosa penis und Corpus spongiosum penis), deren Füllung mit Blut zur Erektion führt. Die Urethra ist bis zur Einmündung der Ductus ejaculatorii von Übergangsepithel ausgekleidet. Danach geht das Übergangsepithel in ein mehrreihig hochprismatisches Epithel über, das im weiteren Verlauf mehrschichtig hochprismatisch und letztendlich ab der Fossa navicularis, zu einem mehrschichtig unverhornten Plattenepithel wird. Unter der Basallamina des Epithels liegt eine dünne Lamina propria. In die Urethra münden die Gll. bulbourethrales und Gll. urethrales bzw. paraurethrales. Hauptverantwortlich für die erektile Funktion des Penis sind die beiden dorsal liegenden Corpora cavernosa. Diese werden durch eine sie gemeinsam umgebende, derbe und kaum dehnbare, kollagene Bindegewebshülle, die Tunica albuginea, zu einer Einheit zusammengefasst. Median sind sie durch einen kammartig durchbrochenen Bindegewebseinschub, das Septum pectiniforme penis, unvollständig voneinander getrennt. Das Schwellgewebe innerhalb der Corpora cavernosa bildet Trabekel aus kollagenem Bindegewebe, in die auch elastische Fasern und glatte Muskelzellen eingelagert sind. Die Trabekel sind von Endothel überzogen und umfassen anastomosierende Hohlräumen, die Cavernae. Die Cavernae erhalten ihr Blut hauptsächlich über die in jedem der beiden Corpora in der Längsachse verlaufende Arteria profunda penis. Ihre Äste, die Arteriae helicinae, durchziehen das Schwellgewebe und münden sowohl in die Cavernae als auch über arterio-venöse Anastomosen in das blutabführende venöse System. Die Arteriae helicinae haben starke Intimapölster aus glatten Muskelzellen (Sperrarterien), über deren Kontraktion bzw. Dilatation der Blutzufluss in die Cavernae geregelt wird. Der Blutabfluss erfolgt über Äste der Vena dorsalis penis, welche die Tunica albuginea schräg durchsetzen und das Blut der außerhalb der Corpora cavernosa verlaufenden Vena dorsalis penis zuführen. Auch diese Venen sind an ihrem Beginn mit Intimapölstern aus glatten Muskelzellen ausgestattet (Sperrvenen). Im nicht-erigierten Zustand fließt der Großteil des Blutes über die Aa. helicinae, deren Intimapölster weitgehend geschlossen sind und die arterio-venösen Anastomosen direkt in die Äste der V. dorsalis penis. Nur ein geringer Teil des Blutes durchströmt die Cavernae. Während der Erektion hingegen sind die Intimapölster der Aa. helicinae geöffnet, die Cavernae sind maximal blutgefüllt. Im Zusammenspiel mit der nicht dehnbaren Tunica albuginea und dem gedrosselten venösen Abfluss resultiert daraus die Festigkeit des erigierten Penis (siehe Thema „Endokrinium des Mannes“). An der Erektion mitbeteiligt ist das ventral gelegene Corpus spongiosum, das die Urethra im Penis umhüllt. Das Corpus spongiosum ist an der Peniswurzel zum Bulbus penis verdickt, geht dann in den Schaft über und bildet an der Penisspitze die Eichel (Glans penis). Wie die Corpora cavernosa ist auch das Corpus spongiosum von einer Tunica albuginea umgeben, die aber wesentlich schwächer ausgebildet ist. Das Corpus spongiosum penis besteht aus einem Venengeflecht (venöser Schwellkörper), wodurch es selbst bei maximaler Blutfüllung bei weitem nicht die Festigkeit der Corpora cavernosa erreicht. Die Urethra bleibt somit für die Ausstoßung des Ejakulats durchgängig. Alle drei Schwellkörper werden außen von der Fascia penis profunda zu einer funktionellen Einheit zusammengefasst. Über der Fascia liegt eine dünne, stark verschiebbare Schicht lockeren Bindegewebes und darüber die Haut des Penis. Diese ist dünn, fettgewebsfrei und besitzt eine hohe Elastizität. An der Penisspitze geht sie in eine Duplikatur, die Vorhaut (Praeputium), über. Das Epithel ist ein mehrschichtiges unverhorntes bis schwach verhorntes Plattenepithel. Die Penishaut weist Schweiß- und Talgdrüsen auf, an der Innenseite des Praeputiums bildet eine individuell unterschiedliche Anzahl von Talgdrüsen, die Glandulae praeputiales, gemeinsam mit abgestoßenen Epithelzellen das Smegma.
Skrotum: Der Hodensack umgibt Hoden und Nebenhoden. Seine Entstehung aus einer ursprünglich paarig angelegten Anlage ist noch an der median verlaufenden Verschmelzungsnaht, der Raphe scroti, erkennbar. Das mehrschichtige Plattenepithel der Haut ist nur mäßig verhornt und meist stärker pigmentiert, neben Schweiß- und Talgdrüsen treten auch apokrine Duftdrüsen auf, Haare sind obligatorisch und im Stratum texticulare der Cutis und der Subcutis finden sich Bündel glatter Muskelzellen (Tunica dartos); ihre Kontraktion bewirkt eine Fältelung der Haut.
Literatur
Lüllmann-Rauch R.: Histologie; 6. Aufl.; Georg Thieme Verlag, 2019.
Weipoltshammer K. und Pusch O.: Histologie: Meiose und männliche Genitalorgane; Vorlesungsunterlagen lt. Studyguide, Block 15.
Normale und gestörte Organentwicklung
Die Geschlechtsentwicklung
Christian Schöfer
Zunächst wird die morphologische Entwicklung der Sexualorgane beschrieben und danach jene Faktoren, die für die Geschlechtsbestimmung eine Rolle spielen. Bei den Sexualorganen wird auf die Herkunft des Baumaterials kurz eingegangen, um danach die Entwicklung der Gonaden, der ableitenden Wege und des äußeren Genitales darzulegen. Zuletzt wird als Beispiel für sekundäre Geschlechtsmerkmale die Entwicklung der Brustdrüse besprochen. Bei der Geschlechtsbestimmung wird zunächst auf die zugrundeliegenden Mechanismen eingegangen, bevor die verschiedenen Ebenen der Geschlechtsdifferenzierung sowie deren Varietäten besprochen werden. Zuletzt wird auf den Einfluss äußerer Faktoren auf die Geschlechtsentwicklung eingegangen.
Begrifflichkeiten: Im Allgemeinen wird von Begriffen wie „Fehlbildung“ und „Störung“ im Kontext der Geschlechtsentwicklung wenig Gebrauch gemacht, da sie einerseits ungeeignet sind, die individuelle Bandbreite anatomischer Strukturen neutral zu bezeichnen und andererseits den Eindruck erwecken, es läge eine medizinische Behandlungsnotwendigkeit derselben vor. Im Folgenden werden die Begriffe „Fehlbildung“ und „Störung“ lediglich dort verwendet, wo Entwicklungsvorgänge zu schweren körperlichen Defekten führen oder eine medizinische Behandlung angezeigt ist. Ansonsten findet analog zur Bezeichnung „Differences of Sex Development“ (DSD) der neutrale Begriff „Varietät“ Verwendung, um die individuelle Bandbreite anatomischer, nichtbehandlungsbedürftiger Strukturen zu bezeichnen.
1 Entwicklung der Sexualorgane
Zwei Grundprinzipien kennzeichnen die Entwicklung der Sexualorgane:
(1)Die Entwicklung der Sexualorgane ist in enger Verbindung mit der Entwicklung der Harnorgane zu verstehen, daher auch der Name Urogenitalorgane (zur Entwicklung der Harnorgane siehe auch Block 14).
(2)Alle Sexualorgane durchlaufen indifferente (= bipotenzielle) Stadien. In den indifferenten Stadien ist vom morphologischen Aspekt her keine Differenzierung in männliche oder weibliche Richtung erkennbar (je nach Abschnitt der Sexualorgane dauert das indifferente Stadium bis zwischen Mitte und Ende des zweiten Entwicklungsmonats).
1.1 Genese des Baumaterials – Menschliche Frühentwicklung (siehe Block 3)
Geschlechtsorgane sind primär mesodermale Bildungen!
In der dritten Entwicklungswoche (EW) entsteht durch den Vorgang der Gastrulation ein Embryo mit drei Keimblättern. Entlang des Primitivstreifens invaginieren Zellen des Epiblasts und bilden Entoderm und Mesoderm. Das Mesoderm organisiert sich zu den segmental angelegten, paraxialen Somiten, dem daran anschließenden intermediären Mesoderm und dem Seitenplattenmesoderm (viszerales und parietales Blatt). Sehr früh bildet sich der Urnierenausführungsgang (Wolff’scher Gang). Das Genitalsystem ist eine mesodermale Bildung unter Beteiligung des intermediären und des parietalen Seitenplattenmesoderms.
In der vierten EW kommt es durch die Abfaltung vom Dottersack zur Gestaltsbildung. Dadurch entstehen ein Darmrohr und geschlossene Körperhohlräume, welche von einem flachen Epithel (Zoelomepithel) ausgekleidet werden. Aus dem intermediären Mesoderm differenzieren sich ab nun in zeitlicher Abfolge die Nierenanlagen Pro-, Meso- und Metanephros. An der hinteren parietalen Leibeswand buchtet sich der sich entwickelnde Mesonephros in die Leibeshöhle vor. Im Bereich des Mesonephros entstehen Glomerula und Nierenkanälchen, die in den Wolff´schen Gang münden.
1.2.1Indifferentes Stadium (bis Ende 6. EW)
An der Ventralseite des Mesonephros verdickt sich das Coelomepithel, es wird nun als Keimepithel bezeichnet und ist als Genitalleiste abgrenzbar (sie bildet zusammen mit dem Mesonephros die Urogenitalleiste), welche die Gonadenanlage darstellt und sich folgerichtig ebenfalls in die Leibeshöhle vorwölbt. Die Genitalleiste erhält ein mesenchymales Inneres. Die Urkeimzellen wandern von der kaudalen Wand des Dottersackes in die Gonadenanlagen und treffen dort in der 5. EW ein. Vom Keimepithel ziehen solide Zellstränge ins Innere der Gonadenanlage (primäre Keimstränge) und die Urkeimzellen wandern in die primären Keimstränge ein. Fehlgeleitete Wanderung der Urkeimzellen lässt strukturierte, hormonell aktive Keimdrüsen entstehen, in denen jedoch keine Keimzellen gebildet werden können.
1.2.2Geschlechtsspezifische Entwicklung (ab 7. EW)
1.2.2.1Testis
Aus den primären Keimsträngen werden die Samenstränge. Sie verlieren den Kontakt zum Zoelomepithel und nehmen eine U-förmige Gestalt an. Von isolierten Zellen an den Enden der Samenstränge ausgehend, bildet sich das Rete testis. Die vorpubertären Samenstränge bestehen aus den Keimzellen und Sertolizellen. Die Sertolizellen arretieren die Keimzellen, sodass sie sich weder mitotisch noch meiotisch teilen. Es findet keine Spermienproduktion statt und die Stränge besitzen kein Lumen; dieses tritt erst mit dem Beginn der Spermatogenese während der Pubertät auf. Die Sertolizellen sind von äußerster Wichtigkeit für die Entwicklung in die männliche Richtung. Insbesondere exprimieren sie das SRY-Gen am Y-Chromosom und treiben so die Entwicklung in die männliche Richtung. Aus dem Mesonephros wandern Zellpopulationen ein, die sich zu den peritubulären Zellen (später Myofibroblasten), zu den zwischen den Samensträngen liegenden Leydig’schen Zwischenzellen, welche für die Testosteronbildung hauptverantwortlich sind, und zu Blutgefäßen differenzieren. Es existieren zwei Generationen von Leydig’schen Zwischenzellen; die 1. Generation ist für die fetale Differenzierung des Hodens verantwortlich, die 2. Generation ist für die Initiierung der Spermatogenese ab der Pubertät verantwortlich (daher postnatal niedrigeres Testosteronniveau als fetal).
1.2.2.2Ovar
Die primären Keimstränge gehen zugrunde und aus dem Keimepithel entstehen sekundäre Keimstränge, in die die Keimzellen einwandern und sich mitotisch teilen (ca. 1 Mio. Oogonien). Diese Strukturen zerfallen zu sogenannten Eiballen, Einheiten von einer Keimzelle mit umgebender, einschichtiger Hülle (Follikelzellen). Die Keimzellen beginnen sogleich mit der Meiose. Die Tatsache, dass die Keimzellen in die Meiose einsteigen, bedingt wahrscheinlich den Zerfall der Keimstränge zu Eiballen. Durch die Follikelzellen werden die Oogonien in der Prophase der ersten Reifeteilung arretiert (Diktyotänstadium).
Varietäten der Keimdrüsen: Ovotestis; Keimdrüsen, in denen räumlich getrennt sowohl Ei- als auch Spermienproduktion stattfindet. Im testikulären Dysgenesiesyndrom (TDS) wird eine nicht komplette Differenzierung fetaler Keimzellen zu Spermatogonien als Ursache mehrerer Fehlbildungen (z. B. Deszensusstörungen, Hypospadie etc.) mit später erhöhtem Risiko der Entstehung nonseminomatöser Hodentumore angesehen.
1.2.2.3Deszensus der Keimdrüsen
Männliche und weibliche Keimdrüsen machen durch relative Wachstumsverschiebung eine Lageveränderung nach kaudal durch. Diese ist beim männlichen Geschlecht deutlich stärker ausgeprägt. Der Hoden gelangt durch Fixierung am Gubernaculum testis in das Skrotum. In dieses buchtet sich eine Ausstülpung der Peritonealhöhle vor (Processus vaginalis), die nach erfolgtem Deszensus die Verbindung zur Peritonealhöhle verliert.
Varietäten: Falls die Verbindung zur Bauchhöhle nicht obliteriert, besteht die Gefahr der Reponierung des Hodens in die Bauchhöhle und somit die Gefährdung der Spermienintegrität.
1.3Entwicklung der ableitenden Wege
1.3.1Indifferentes Stadium
Der Wolff’sche Gang (WG) wird bereits in der 3. EW als paariger Urnierenausführungsgang angelegt und mündet in die Kloake. Er induziert die Bildung des Müller’schen Ganges (MG), der sich als Einstülpung des Zoelomepithels von kranial nach kaudal vorwärtsschreitend bildet. Dieser verläuft zunächst lateral des WG, überkreuzt ihn kaudal und mündet medial des WG in die Kloake, bzw. nach deren Septierung in den Sinus urogenitalis. Am Ende des indifferenten Stadiums existieren WG und MG als zwei jeweils paarige Ausführungsgänge nebeneinander, die in weiterer Folge für die Ableitung der Geschlechtsprodukte verantwortlich sein werden.
Infolge der Bildung des Metanephros geht der Mesonephros kranial der Gonadenanlage zugrunde. Im Bereich der Hodenanlage bleibt er bestehen und die Nierenkanälchen nehmen Kontakt zum Rete testis auf. Aus ihnen werden die Ductuli efferentes des Nebenhodens. Kaudal der Hodenanlage obliterieren die Nierenkanälchen. Der WG wird zum Ductus epididymidis und zum Ductus deferens (aus dem heraus sich auch die Samenbläschen differenzieren). Der MG wird aktiv reduziert (Anti-Müller-Hormon AMH der Sertolizellen). Reste des MG: Appendix testis und Utriculus prostaticus; Reste des Mesonephros: Appendix epididymis und Paradidymis.
Der Mesonephros mit dem WG wird passiv reduziert (der WG benötigt zur Persistenz einen hohen Testosteronspiegel). Die MG bleiben erhalten und verschmelzen kaudal. Aus ihnen entstehen die Tuben und der Uterus in der medialen Verschmelzungszone, sowie der proximale Anteil der Vagina. Reste des Mesonephros: Epoophoron, Paroophoron, Gartner’scher Gang oder Zysten (ganz oder teilweise persistierender WG mit Hang zu Entzündungen und Fistelbildung). Für die Bildung der einzelnen Abschnitte des MG sind HOX-Gene verantwortlich: HOXA9 (Tuben), HOXA10 (Corpus uteri), HOXA11 (Corpus uteri und Cervix), HOXA13 (Vagina).
Varietäten: In Abhängigkeit vom Hormonspiegel (AMH und Testosteronüber- bzw. -unterproduktion) können Zwischenstadien ausgebildet werden. Hypo- und Aplasien, aber auch Duplikaturen, bes. Uterus und Vagina betreffend (z. B. Uterus bicornis).
1.3.4Lagebeziehung Wolff’sche und Müller’sche Gänge zu Harnblase; Vagina
Von den WG sprossen die Ureteren aus. Durch Einbeziehung des distalen Teils der WG in die Harnblase resultiert eine getrennte Einmündung von WG und Ureteren. Im männlichen Geschlecht verlagert sich die Mündung der WG nach kaudal in den Bereich der späteren Pars prostatica urethrae. Beim weiblichen Geschlecht überkreuzen die, proximal lateral der WG entstandenen, MG nach kaudal die WG und verlaufen dorsal der Harnblase medial von diesen und verschmelzen miteinander (Uterusbildung). Die Einmündungsstelle des Uterus in die Urethra wird so weit nach kaudal verschoben, bis sie getrennt von der Urethra nach außen mündet. Während dieser Wanderung kommt es zur Bildung einer soliden Vaginalplatte, die im proximalen Drittel aus dem Mesoderm (MG) und in den distalen zwei Dritteln aus dem Entoderm (Urethra) entsteht. Die Vaginalplatte wird im Laufe der Entwicklung kanalisiert, wobei im Bereich der Mündung der Vagina eine häutige Membran teilweise bestehen bleibt (Hymen).
Varietäten: unvollständige Lumenbildung der Vagina; zu hoher Testosteronspiegel kann zu unvollständiger Verlagerung der Vaginalplatte führen.
1.3.5Entwicklung von Samenblase und Prostata
Die Vesicula seminalis entsteht als Aussackung des WG während der Differenzierung zum Ductus deferens im distalen Bereich. Im Bereich der gesamten Urethra entstehen periurethrale Drüsenanlagen, die im Bereich der späteren Prostata besonders dicht vorhanden sind. Die zunächst isoliert vorliegenden Drüsen erhalten erst später ihre anatomisch einheitlich erscheinende Form. Ihr Ursprung aus unterschiedlichen Drüsenanlagen ist in der adulten Drüse histologisch ablesbar und die verschiedenen Drüsenteile haben distinkte klinische Relevanz. Samenblase und Prostata werden erst ab der Pubertät sekretorisch aktiv. Im weiblichen Geschlecht sind ebenfalls Prostatadrüsen angelegt, die jedoch klein und wahrscheinlich inaktiv bleiben.
1.4 Entwicklung des äußeren Genitales
Das indifferente Stadium existiert bis etwa Ende 8. EW. Angelegt sind ein unpaarer Genitalhöcker, kaudal davon paarige Genitalfalten und lateral davon paarige Genitalwülste. Beim weiblichen Geschlecht bleibt der Genitalhöcker im Vergleich zum männlichen Geschlecht im Wachstum zurück und die Genitalfalten dehnen sich nach kaudal aus. Der Genitalhöcker wird zur Klitoris, die Genitalfalten zu den Labia minora. Die Genitalwülste dehnen sich nach kranial um den Genitalhöcker aus und aus ihnen entstehen die Labia majora. Beim männlichen Geschlecht wächst der Genitalhöcker vergleichsweise stärker und es entsteht die dorsale Penisseite mit den Corpora cavernosa. Die Genitalfalten legen sich an seine Unterseite an und verschmelzen median. Aus den Genitalfalten entsteht der ventrale Teil des Penis mit dem Corpus spongiosum, der Glans penis und der Urethra, deren Öffnung durch diesen Prozess an die Penisspitze verlagert wird. Die Genitalwülste verlagern sich nach kaudal und verschmelzen median. Aus ihnen entsteht das Skrotum. Während der Entwicklung des äußeren Genitales verschwindet die gemeinsame Kloakenöffnung durch das Vorwachsen des Septum urorectale, welches die Separation der Kloake in Rektal- und Urogenitalbereich bedingt (Dammbildung).
Fehlbildungen und Varietäten: Hypospadie: leckende Urethra an der Ventralseite des Penis durch Verschlussstörung der Genitalfalten; häufig, meist isoliert vorkommend oder mit genetischem oder teratologischem Hintergrund; selten: Epispadie (leckende Urethra an der Oberseite des Penis), Hypo- oder Hypergenitalismus (Cave: Hypogenitalismus versus Hypogonadismus – Letzteres bezeichnet zu niedrige Sexualhormonproduktion (Physiologie)); Doppelbildung der Genitalhöcker (doppelte Klitoris, doppelter Penis); in Abhängigkeit vom Hormonspiegel nicht eindeutig männlich oder weiblich ausgebildete äußere Genitalien (siehe unten).
1.5 Sekundäre Geschlechtsmerkmale – Entwicklung der Brustdrüse
Die Brustdrüse ist ein Hautanhangsgebilde. Auch hier existiert ein indifferentes Stadium, das bei beiden Geschlechtern gleich ausgeprägt ist. Ab der 4. EW sind kurzfristig paarige Hautleisten bemerkbar, die in einer geschwungenen Linie von der Achsel- in die Leistenregion ziehen, die sogenannten Milchleisten. Entlang dieser verdickten Leisten besteht die Potenz zur Milchdrüsenbildung. In der 5. EW werden die Leisten bis auf die Höhe des 4. Interkostalbereichs reduziert, wo ein solider Epithelzapfen nach innen vorwächst. Ab der 10. EW beginnt sich dieser Epithelstrang zu verzweigen, bis sich zur Geburt etwa 15–20 Drüsenlappen gebildet haben. Ab der 20. EW beginnt die Lumenbildung der Zellstränge, wodurch Ductus und Sinus lactiferi entstehen. Auch ab der 5. EW beginnt die Bildung der Areolae und der zunächst invertierten Brustwarze („Milchgrube“), welche nachgeburtlich evertiert wird. Perinatal erhöhte kindliche Prolaktinproduktion (ausgelöst durch sinkende maternale Östrogenkonzentration im neonatalen Blut) kann in beiden Geschlechtern kurzzeitig Sekretproduktion der Brustdrüse induzieren („Hexenmilch“). Durch den nachgeburtlichen Abfall der Geschlechtshormonkonzentration im Blut kommt es zur teilweisen Regression des Drüsengewebes. Bis zum Beginn der Pubertät lassen sich anatomisch-histologisch keine geschlechtsspezifischen, wohl aber individuelle Unterschiede in der Brustdrüsenausprägung feststellen. Im männlichen Geschlecht verhindert die Testosteronproduktion ab der Pubertät ein Wachstum des Brustdrüsengewebes, während dieses im weiblichen Geschlecht durch die weiblichen Geschlechtshormone stimuliert wird. Daraus ergibt sich, dass sowohl Androgen- als auch Östrogen- und Progesteronrezeptoren in Brustdrüsengewebe exprimiert werden.
Varietäten: Polythelie (zusätzliche Brustwarzen; bei 1–3 % der männlichen und 2–5 % der weiblichen Neugeborenen), seltener Polymastie (zusätzliche Brustdrüsen) entstehen durch unvollständige Reduktion von Brustdrüsengewebe entlang der Milchleisten. Seltener sind Hypo- und Aplasie des Brustdrüsengewebes sowie Amastie (völliges Fehlen von Drüsengewebe wie auch Areolae und Warzen).
2.1 Regulation der Geschlechtsdeterminierung
In den 1940er-Jahren konnte durch intrauterines Entfernen der Gonaden bei Kaninchen gezeigt werden, dass alle Nachkommen rein weiblich waren. Damit war klar, dass die Expression eines Y-chromosomal gebundenen Faktors in den Gonadenanlagen für die Entwicklung in männliche Richtung verantwortlich sein muss. Erst 1990 konnte dieses Gen auf dem Y-Chromosom identifiziert werden: SRY (sex determinating region on the Y), das einen Transkriptionsfaktor codiert.
Der weitere Wirkmechanismus scheint über zwei einfache Regelkreise zu laufen, die sich im indifferenten Stadium in einem labilen Gleichgewicht befinden. Die beiden Regelkreise agieren für sich als positive Rückkoppelungsmechanismen, die sich gegeneinander inhibieren. Der Regelkreis SOX9/FGF9 ist für die Entwicklung in die männliche, jener WNT4/RSPO1 für die Entwicklung in die weibliche Richtung verantwortlich. Die Expression von SRY reguliert SOX9/FGF9 hin- auf, wodurch der WNT4/RSPO1 Regelkreis inhibiert wird. Bei Fehlen von SRY reguliert WNT4/RSPO1 den SOX9/FGF9 Regelkreis hinunter und die Entwicklung des Individuums verläuft in die weibliche Richtung.
SRY wird in den Prä-Sertolizellen der primären Keimstränge exprimiert. Dies führt zur Arretierung der Keimzellen in der Interphase (keine Zellteilung), sowie zur Rekrutierung von Leydig´schen Zwischenzellen, die Testosteron bilden. Außerdem bilden die Sertolizellen das Anti-Müller-Hormon, welches den MG zur Reduktion veranlasst. Testosteron wirkt einerseits auf die Keimstränge zurück (Differenzierung der Sertolizellen), andererseits wirkt es auf die anderen primären und sekundären Geschlechtsmerkmale, aber auch auf das Gehirn (Androgenrezeptoren kommen in mehreren Gehirnarealen vor). Dies geschieht durch Interaktion mit den in den Zielzellen vorhandenen Testosteronrezeptoren, die etwa Zellwachstum auslösen (z.B. Genitalhöcker, Prostata) oder die Regression von Strukturen unterbindet (z.B. Persistenz der WG). Testosteron selbst wirkt auf die Entwicklung von Hoden und Wolff’sche Gänge, während zur Differenzierung von Samenbläschen, Prostata und anderer urethra-assoziierter Drüsen ebenso wie der externen Genitalien, dem Haarwuchsmuster etc. 5α-Dihydrotestosteron (DHT) benötigt wird. Dieses, durch 5α-Reduktase umgewandelte Testosteron, bindet wesentlich effizienter an Androgenrezeptoren als Testosteron selbst. Diese enzymatische Reaktion passiert in den Zielzellen selbst (Androgenrezeptoren sind intrazellulär lokalisiert).
2.2 Genetisch bedingte Varietäten der Geschlechtsentwicklung
Vier Ebenen der Geschlechtsdeterminierung
Varietäten können auf allen Ebenen der Geschlechtsdetermination stattfinden. Oft führen sie zu nicht eindeutig ausgeprägten Geschlechtsmerkmalen (Intersex).
Tab. 1
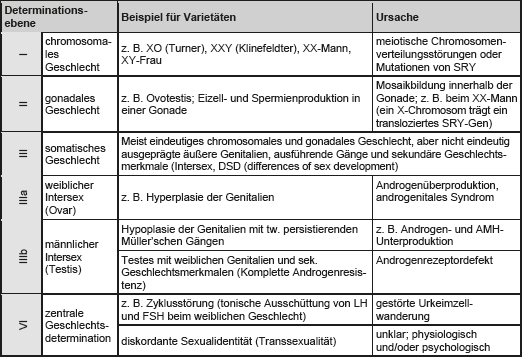
2.3 Exogen bedingte Varietäten der Geschlechtsentwicklung
Von außen zugeführte Substanzen können die Geschlechtsentwicklung beeinflussen. Teratogene Substanzen verursachen oft schwerwiegende, anatomisch manifeste Varietäten. Substanzen, die in die hormonelle Steuerung der Sexualentwicklung eingreifen (endokrine Disruptoren), zeigen oft geringfügige Veränderungen und manifestieren sich funktionell oft erst ab der Geschlechtsreife.
2.3.1Teratologische Varietäten – Beispiel Retinsäure
Das Vitamin-A-Derivat Retinsäure reguliert die Expression von HOX-Genen (siehe Block 5). Exogen zugeführte Retinsäure ist leicht plazentagängig und bewirkt Expressionsstörungen der HOXGene und stört, je nach Expositionsfenster, die Musterbildung in den Müller´schen Gängen.
2.3.2Endokrine Disruptoren („Xenohormone“)
Diese Substanzen zeigen Bindungsaffinität zu den Rezeptoren der Geschlechtshormone, meist Östrogenrezeptoren, wodurch der Rezeptor entweder blockiert (Antagonist) oder aktiviert (Agonist) wird. Paradoxerweise ist ihre Wirksamkeit oftmals bei geringer Konzentration höher als bei hohen Konzentrationen, da Mechanismen zur Regulation der Geschlechtshormonkonzentration im Blut unterlaufen werden. Die resultierenden phänotypischen Veränderungen sind milde und mitunter schwer diagnostizierbar, jedoch zeigt sich eine eingeschränkte Funktion der Geschlechtsorgane bis hin zum erhöhten Krebsrisiko nach Beginn der Geschlechtsreife. Endokrine Disruptoren können auch generationenübergreifend wirken (Keimbahnwirkung). Als Xenohormone wirken manche Therapeutika (z. B. Diethylstilbestrol), Umweltgifte wie Herbizide (z. B. Atrazin) und Stoffe der Kunststoffzeugung (z. B. Bisphenol A, Polychlorierte Biphenyle), oder natürliche pflanzliche Substanzen („Phytoöstrogene“, z. B. Genistein der Sojabohne). Aufgrund der langen Latenzzeit, der geringen Expositurkonzentrationen und der unterschiedlichen individuellen Sensitivitätsniveaus ist es oft schwierig, einen Stoff zweifelsfrei als endokrinen Disruptor zu identifizieren.
2.3.2.1Beispiel Diethylstilbestrol (DES)
Ab den 1940er-Jahren primär in den USA verschriebenes Medikament zur Senkung des Abortrisikos. Später wurde eine milde Fehlbildung des Uterus nach Einnahme von DES durch die Mütter der Patientinnen festgestellt („T-förmiger Uterus“), sowie ein erhöhtes Vorkommen von Cervix-Aberrationen bis hin zum Vorkommen des Cervix-Klarzellkarzinoms. Interessanterweise ist dieser Effekt auch noch bei den Töchtern jener Patientinnen feststellbar gewesen, die Wirkung des DES ist also generationenübergreifend. Im Tierversuch wurde gezeigt, dass DES die Expression von Hoxa10 in den Müller´schen Gängen reduziert und dadurch Zellspezifizierung an den Grenzen Tube-Ovar-Cervix gestört wird. Auch bei Buben wurden DES-induzierte Auswirkungen beschrieben, wie z. B. Zysten in den Tubuli efferentes des Nebenhodens und Oligospermie. Anfang der 1970er-Jahre wurde DES vom Markt genommen.
2.3.2.2Beispiel Bisphenol A (BPA)
Dient seit den 1930er-Jahren als Ausgangsprodukt zur Synthese polymerer Kunststoffe und wird unter anderem in der Auskleidung von Nahrungsmittelkonserven und Trinkflaschen sowie als Weichmacher in Kunststoffen (Kinderspielzeug, Dentalfüllungen) oder als Flammschutzmittel verwendet. BPA diffundiert über die Zeit aus dem Kunststoff heraus und sammelt sich in der Umwelt an, ein Vorgang der durch Hitze, Säuren und Laugen beschleunigt wird.
Im Tierversuch führt BPA-Exposition z. B. zu vermehrt auftretenden Aneuploidien in den Oozyten und zu höherer Sensitivität des Brustdrüsengewebes gegenüber weiblichen Geschlechtshormonen, gefolgt von höherer Brustkrebsrate, sowie Pubertas praecox. Bei männlichen Versuchstieren prädisponiert BPA die Bildung von Prostatakarzinom. BPA inaktiviert den Östrogenrezeptor beta und scheint die Mikrotubuluspolymerisation zu stören (siehe meiotische Aneuploidien).
In der EU ist der Verkauf von Babytrinkflaschen mit BPA-haltigen Weichmachern seit Ende 2010 verboten.
2.3.3Varietäten der Geschlechtsreifung
Nach dem nachgeburtlichen Abfall der Geschlechtshormonkonzentration im Blut steigt diese erst wieder in der Pubertät an und bewirkt die Ausprägung der sekundären Geschlechtsmerkmale. Beim 5-alpha-Reduktasemangel im männlichen Geschlecht entwickeln sich die Keimdrüsen und ableitenden Wege (hier wirkt Testosteron) normal, die äußeren Genitalien sind jedoch durch das Fehlen des hier wirkenden DHTs inklusive des fehlenden Deszensus des Hodens weiblich ausgeprägt. In der Pubertät kommt es durch den massiven Anstieg des Testosterons zu einem Wachstumsstimulus der äußeren Genitalien und die vermeintliche Klitoris nimmt die Gestalt eines Penis an (oft mit Hypospadie assoziiert), zudem kommt es zu einer Komplettierung des Hodendeszensus. Buben mit 5-alpha-Reduktasemangel stehen vor der enormen psychischen und sozialen Belastung, als Mädchen erzogen worden zu sein und in der Pubertät möglicherweise ihre Sexualidentität wechseln zu müssen. In manchen Gegenden Brasiliens und besonders der Dominikanischen Republik tritt dieser Enzymdefekt gehäuft auf. Dort nennt man diese Männer Guevedoces (etwa „Eier mit 12“) und sie haben wegen des gehäuften Vorkommens weniger soziale Probleme.
Empfehlenswerte Lehrbücher
Thomas W. Sadler: Medizinische Embryologie, Thieme Verlag.
Bruce M. Carlson: Human Embryology and Developmental Biology, Elsevir Verlag.
Patricia G. Oppelt: Kinder- und Jugendgynäkologie, Thieme Verlag.
Schöfer C.: Die Geschlechtsentwicklung; Vorlesungsunterlagen lt. Studyguide, Block 15.
Fehlbildungen des weiblichen Genitales
Christine Kurz
Als weibliche genitale Fehlbildungen bezeichnet man angeborene Anomalien des inneren oder äußeren Genitales, deren Ursache bisher weitgehend ungeklärt ist. Zu der sehr heterogenen Gruppe der DSD („disorders of sexual development“) gehören angeborene Abweichungen der Geschlechtsdifferenzierung mit einer fehlenden Übereinstimmung von chromosomalem, gonadalem und phänotypischem Geschlecht. Die Prävalenz von genitalen Fehlbildungen in der weiblichen Gesamtbevölkerung liegt zwischen 0,1 und 5 %.
Die Müllergänge stellen die Urkomponenten des weiblichen Fortpflanzungstraktes dar. Während der Embryogenese differenzieren sie sich in die Eileiter, den Uterus, den Gebärmutterhals und den oberen Anteil der Vagina. Dieser Anteil bildet durch Anschluss an den mittleren Teil des Sinus urogenitalis die Vagina. Wenn die Verschmelzung der beidseits angelegten Müller-Gänge gestört ist, sogenannte Fusionsdefekte, kann es zu einer doppelten Anlage von Uterus und Vagina kommen. Die Bandbreite reicht dabei vom Uterus arcuatus über den Uterus bicornis bis hin zum vollständigen Uterus duplex. Bei fehlender Fusion mit dem Sinus urogenitalis ergeben sich obstruktive Müller-Anomalien. Neben den Fusionsdefekten kann es zu sogenannten Resorptionsdefekten kommen: Hier werden die nach der Fusion zunächst bestehenden kontaktbildenden Wandstrukturen nicht resorbiert. Es verbleiben Septen wie z. B. beim Uterus septus oder beim longitudinalen und transversen Vaginalseptum. Ein gleichzeitiges Auftreten einer ipsilateralen Nierenagenesie bei Patientinnen mit Uterus didelphys und einseitig verschlossener Hemivagina wird in der Literatur mit einer Assoziation von 100 % beschrieben. Die Nierenagenesie und obstruierte Hemivagina tritt im Verhältnis 2:1 häufiger rechts als links auf. In Bezug auf die Symptomatik klagen die Patientinnen am häufigsten über Unterbauchschmerzen (90 %), gefolgt von einer Beckenraumforderung (40 %) und Drucksymptomen.
Bei einer Menstruationsstörung sind eine Hämatometra, eine Hämatosalpinx und eine Endometriose die Hauptgründe für zyklische Unterbauchschmerzen und Menometrorrhagien. Bei Frauen mit Uterus didelphys wird eine Endometriose in 17–35 % der Fälle beschrieben.
Der Ausschluss einiger genitaler Fehlbildungen sollte bereits im Rahmen der Erstuntersuchung nach der Geburt durch Inspektion der Anogenitalregion mit vorsichtigem Spreizen der Labien erfolgen. Zu achten ist dabei auf einen geöffneten Anus, die Größe der Klitoris, das Vorhandensein eines Fluor neonatalis, ein gut östrogenisiertes Hymen und die Urethralöffnung.
Die Beurteilung des Introitus und des Hymens ist auch bei Mädchen und jungen Frauen durch die Separation und Traktion der Labien nach dorsal schmerzfrei möglich. Eine Sondierung der Vagina kann bei Bedarf mit einem angefeuchteten Wattetupfer erfolgen.
Ein abdominaler Ultraschall bei gefüllter Harnblase ist bei Mädchen häufig ausreichend. Eine Narkoseuntersuchung ist selten erforderlich. Die interdisziplinäre Kooperation mit Kinderärzten, pädiatrischen Endokrinologen, Kinderchirurgen und Kinderurologen ist im Einzelfall notwendig.
Genitale Fehlbildungen können die zukünftige Fertilität und Sexualität der Betroffenen maßgeblich beeinflussen, daher ist eine ausreichende und einfühlsame Aufklärung über Diagnose und mögliche Behandlungen nötig. Generell gilt, dass zur Diagnosestellung genitaler Auffälligkeiten meistens nur wenige Untersuchungen notwendig sind. Bei der Diagnosestellung sollte der erhobene Untersuchungsbefund genau beschrieben und am besten in einer Zeichnung dargestellt werden, damit er auch für Betroffene und deren Eltern verständlich ist.
Für die Einordnung bzw. Beschreibung von Fehlbildungen stehen unterschiedliche Einteilungen zur Verfügung: AFS (American Fertility Society)-Klassifikation, Klassifikationssystem von Acien, ESHRE/ESGE (European Society of Human Reproduction and Embryology/European Society for Gynaecological Endoscopy)-Klassifikation.
Mittels einer ausführlichen Anamnese, einer vaginale Inspektion mit Beurteilung von Mons pubis, Leiste, Labia majora und Labia minora, Harnröhre, Hymen und Introitus sowie mittels abdominellen Ultraschall kann eine Diagnose gestellt werden.
Weiterführende Untersuchungen, wie Hormonbestimmungen, endokrine Funktionstests, Chromosomenanalyse, bildgebende Verfahren (z. B. Magnetresonanztomographie, MRT) oder die operative Abklärung sind nur bei wenigen Fällen oder ergänzend notwendig.
Grundsätzlich stellt sich bei Kindern und Jugendlichen mit Verdacht auf genitale Fehlbildungen die Frage nach Art und Ausmaß der therapeutischen Maßnahmen.
Vaginale Fehlbildungen werden häufig erst in der Pubertät durch ausbleibende Menarche, Problemen mit Tampons oder beim Geschlechtsverkehr auffällig.
Uterine Fehlbildungen werden sehr oft erst in der reproduktiven Phase bei bestehendem Kinderwunsch entdeckt.
Welche Art und Ausprägung vaginaler und uteriner Fehlbildungen vorliegt, ist durch die embryologische Entwicklung des weiblichen Genitales sowie vom eventuellen Vorliegen genetischer Veränderungen beeinflusst. Das untere Drittel der Scheide entwickelt sich aus dem Sinus urogenitalis, wohingegen die proximalen drei Viertel der Scheide, Uterus und Tuben aus den Müller-Gängen entstehen. Fehlbildungen im kaudalen (Uterus, Zervix und Vagina) Bereich können durch das Ausbleiben der Verschmelzung der primär paarig angelegten Müller-Gänge entstehen. Der kraniale Teil der Müller-Gänge bleibt paarig und bildet die Tuben. Aufgrund dieser embryonalen Entstehungsmechanismen erklärt sich auch, warum Fehlbildungen im Bereich der distalen Scheide wie Hymenalfehlbildungen in der Regel isoliert und Fehlbildungen der proximalen Scheide und des Uterus häufig kombiniert auftreten. Nicht selten sind Fehlbildungen des inneren Genitales auch mit anderen Fehlbildungen vergesellschaftet, beispielsweise an Nieren, am Skelett oder am Nervensystem.
Der Zusammenhang mit der Entwicklung der Müller-Gänge erklärt auch, warum Mädchen mit vaginalen oder uterinen Fehlbildungen normal funktionsfähige Ovarien und dadurch bedingt eine normale Pubertät durchlaufen.
Leitsymptomgenitaler Fehlbildungen bei Kinder- und Jugendlichen ist daher die primäre Amenorrhö bei normalem Pubertätsverlauf.
Bei Frauen mit habituellen Aborten oder rezidivierenden Spätaborten bzw. Frühgeburten sollte eine uterine Fehlbildung, wie z. B. ein Uterus subseptus, ausgeschlossen werden.
Eine vaginale und transabdominale Sonographie sind hier häufig bereits hinweisend. Bei jeder vaginalen Sonographie einer Patientin mit aktuellem oder prospektivem Kinderwunsch sollte auf einen doppelten Endometriumreflex („Katzenaugenphänomen“) im Querschnittbild geachtet werden. Mit Hilfe einer 3-D-Sonographie oder einer MRT des Beckens kann die Diagnose bestätigt werden. Eine diagnostische Hysteroskopie und Laparoskopie bei sonographischem Hinweis auf Doppelbildung sind nur bei Kinderwunschpatientinnen erforderlich.
Doppelbildungen (longitudinales Vaginalseptum) oder Verschlussfehlbildungen (transversales Vaginalseptum) der Vagina sind häufig mit Fehlbildungen des Uterus vergesellschaftet, da die kranialen drei Viertel der Vagina ebenso wie der Uterus und die Tuben im Gegensatz zum Hymen embryologisch aus den Müller-Gängen hervorgehen.
Bei einem longitudinalen Vaginalseptum liegt die embryonale Ursache in einer ausbleibenden oder unvollständigen Resorption der Zwischenwand nach Fusion des Ductus paramesonephricus beider Seiten. Sie sind häufig asymptomatisch, können jedoch zu Beschwerden beim Geschlechtsverkehr führen. Ein weiterer klinischer Hinweis ist, wenn anamnestisch trotz einliegendem Tampon weiterhin Menstruationsblut abläuft.
Die operative Entfernung eines longitudinalen Vaginalseptums ist auch bei asymptomatischen Patientinnen indiziert, wenn eine Schwangerschaft bzw. vaginale Geburt geplant ist.
Bei einem partiellen transversalen Septum mit Uterus duplex kommt es zu einer einseitigen Abflussstörung mit Hämatokolpos und Hämatometra. Ein transversales Septum ohne Vagina duplex ist in der Symptomatik mit einer Hymenalatresie vergleichbar.
Uterus (sub)septus
Die operative Therapie des Uterus (sub)septus im Sinne einer hysteroskopischen Septumdissektion ist formell erst bei rezidivierenden Aborten indiziert. Die Patientin sollte jedoch bei Diagnosestellung und aktuellem oder prospektivem Kinderwunsch sorgfältig über den Einfluss auf die Fertilität und die therapeutischen Optionen aufgeklärt werden. Vor einer hysteroskopischen Septumdissektion ist eine diagnostische Laparoskopie zu empfehlen, um einen Uterus bicornis auszuschließen, da dieser hysteroskopisch teilweise sehr ähnlich imponiert, eine Resektion hier jedoch zu einer Perforation führen würde. An der Frauenklinik Wien wird mit Hilfe einer simultan durchgeführten Laparoskopie die hysteroskopische Septumdissektion diaphanoskopisch transfundal begleitet. So kann das gesamte Septum bis in Höhe der Tubenabgänge bei minimalem Perforationsrisiko kontrolliert disseziert werden.
Es gibt keine klare Empfehlung, ab wann eine Konzeption nach hysteroskopischer Septumdissektion empfohlen wird. Untersuchungen konnten jedoch zeigen, dass eine vollständige Heilung des Endometriums nach Septumdissektion 8 Wochen postoperativ erreicht ist. Wir empfehlen jedoch eine aktive Verhütung von mindestens 3 Monaten.
Uterus bicornis/didelphys
Bei einem Uterus bicornis oder didelphys besteht eine erhöhte Rate an Früh- und Fehlgeburten, welche in der Literatur mit 30–50 % angegeben werden. Es besteht ein erhöhtes Risiko für vorzeitige Wehentätigkeit und fetale Lageanomalien. Nur bei Beschwerden im Sinne von Verschlussfehlbildungen mit Ausbildung einer Hämatometra ist eine operative Intervention indiziert. Im Gegensatz zum Uterus (sub)septus ist beim Uterus bicornis eine operative Therapie, z. B. im Sinne einer Metroplastik, nur in Einzelfällen indiziert. In der Literatur werden auch Fälle mit einer Zwillingsschwangerschaft und einer Fruchthöhle in jedem Uterushorn nach spontaner Konzeption mit vaginaler Entbindung beschrieben. Aufgrund eines Uterus didelphys oder Uterus bicornis alleine besteht keine Indikation zur primären Sectio caesarea. Allerdings erscheinen eine engmaschige Betreuung während der Schwangerschaft und die Anbindung an ein Perinatalzentrum empfehlenswert.
Der Uterus unicornis entsteht bei einer ausbleibenden oder unvollständigen Wanderung der Ductus paramesonephricus in Richtung des Sinus urogenitale.
Zum Teil bestehen kontralateral rudimentäre Uterushörner, welche operativ nur entfernt werden müssen, wenn es zu einer Ausbildung einer Hämatometra im rudimentären Horn kommt oder zyklische Unterbauchschmerzen bestehen. Der Uterus unicornis an sich ist meist klinisch inapparent. Aufgrund des im Vergleich kleineren Uterusvolumens kommt es vermehrt zu Aborten (10–40 %) und vermehrt zu Fehlgeburten. Die Fehlgeburtenrate beträgt 29–58 %.
Vaginalhypoplasie/Vaginalaplasie/Zervixaplasie
Treten eine Vaginalhypoplasie, Vaginal- oder Cervixaplasie bei vorhandenem Uterus auf, besteht eine primäre Amenorrhö aufgrund der Abflussbehinderung mit häufig zyklischen, zunehmend starken Unterbauchschmerzen aufgrund Ausbildung einer Hämatometra und retrograder Menstruation.
Hierbei handelt es sich um höchst komplexe und sehr variable Krankheitsbilder mit häufig langjährigen Therapien im Sinne von Rekonstruktionsoperationen ohne oder mit Hilfe von Interponaten (z. B. Darm). Eine Überbrückung bis zum gewählten Zeitpunkt der operativen Therapie ist bei den sehr jungen Patientinnen mittels Einnahme eines oralen Kontrazeptivums im Langzyklus sinnvoll. Häufig ist hier die Hysterektomie die Ultima Ratio. Die interdisziplinäre Betreuung in einem spezialisierten Zentrum ist zu empfehlen.
Mayer-Rokitansky-Küster-Hauser-Syndrom
Wesentlich häufiger als die isolierte Vaginalaplasie ist ein kombiniertes Auftreten mit einer Uterusaplasie z. B. im Rahmen eines MRKH-Syndrom. Das MRKH-Syndrom ist eine angeborene Fehlbildung des weiblichen Genitale im Sinne einer Aplasie des Uterus und der Vagina aufgrund einer Hemmungsmissbildung der Müller-Gänge bisher ungeklärter Ursache mit einer geschätzten Prävalenz von 1:4500. Bei regelrechtem weiblichen Chromosomensatz und normalen Ovarien besteht ein unauffälliger weiblicher Phänotyp mit normalem Hormonprofil, sodass das MRKH-Syndrom meist erst mit fehlendem Einsetzen der Menarche oder Unmöglichkeit der Kohabitation diagnostiziert wird. Die Therapie besteht primär in der Bildung einer Neovagina, um der Patientin ein normales Sexualleben zu ermöglichen. Hier kann zwischen dem Nichtoperativen Dehnungsverfahren und operativen Rekonstruktionsverfahren mit oder ohne die Verwendung von Transplantaten unterschieden werden. Beim konservativen Dehnungsverfahren nach Frank wird das Scheidengrübchen mehrmals täglich mit Dilatatoren gedehnt. Hier besteht der Vorteil der Nichtinvasivität. Nachteil dieser nichtoperativen Methode ist, dass sie eine hohe Motivation der Patientin voraussetzt, häufig schmerzhaft, langwierig und belastend ist sowie das Risiko eines Prolapses besteht. Daher gilt die minimal-invasive Operationsmethode ohne Transplantat, die laparoskopische modifizierte Vecchietti-Methode, als operative Technik der ersten Wahl bei MRKHS. Über einen Dilatator, der über laparoskopisch subperitoneal angelegte Fäden mit einemextrakorporalen Spannappararat verbunden ist, wird in 4–5 Tagen eine Neovagina gebildet. Nach Entfernung des Spannapparates und der Fäden wird bis zur vollständigen Epithelialisierung der Neovagina ein Vaginalphantom als Platzhalter über mehrere Monate verwendet.
Um MRKH-Patientinnen neben einem normalen Sexualleben auch die Umsetzung eines Kinderwunsches zu ermöglichen, erscheint künftig neben der Adoption und der nur im Ausland möglichen Leihmutterschaft auch die Uterustransplantation als eine realistische Option.
Tab. 1. Eshre-Klassifikation
| Klasse | Uterusform |
| U0 | normal |
| U1 | dysmorph |
| _U1a | _T-förmig |
| _U1b | _infantil |
| _U1c | _anderenorts nicht klassifizierbar |
| U2 | septiert |
| _U2a | _partiell |
| _U2b | _komplett |
| U3 | bicornis |
| _U3a | _partiell |
| _U3b | _komplett |
| _U3c | _bicornis septiert |
| U4 | heml |
| _U4a | _mit rudimentärem Cavum |
| _U4b | _ohne rudimentäres Cavum |
| U5 | aplastisch |
| _U5a | _mit rudimentärem Cavum |
| _U5b | _ohne rudimentäres Cavum |
| U6 | nicht klassifizierbare uterine Fehlbildungen |
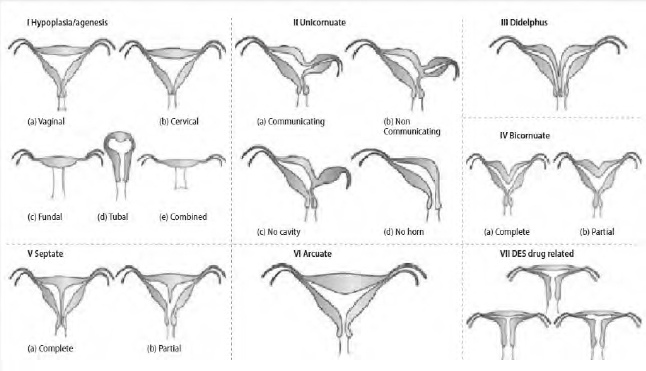
Abb. 1. AFS-Klassifikation
Literatur
Buttram VCJr, Gibbons WE. Muellerian anomalies: a proposed classification (An analysis of 144 cases) Fertil Steril 1979, 32(1): 40-6
Nahum GG (1998) Uterine anomalies. How common are they, and what is their distribution among subtypes?J Reprod Med 43(10):877–887
American Fertility Society (1988) The American Fertility Society classifications of adnexal adhesions, distal tubal occlusion, tubal occlusion secondary to tubal ligation, tubal pregnancies, müllerian anomalies and intrauterine adhesions. FertilSteril 49:944–955
Oppelt P, Renner SP, Brucker S, Strissel PL et al (2005) The VCUAM(Vagina Cervix Uterus Adnex-associated Malformation) classification: a new classification for genital malformations.
Fertil Steril 84: 1493–1497
Grimbizis GF, Gordts S, Sardo A, Brucker SY et al (2013) The ESHRE/ESGE consensus on the classificationof femalegenital tract congenital anomalies.
HumReprod 28(8): 2032–2044
Hong J, Zhu L, Lang J. Clinical characteristics of 70 patients with Herlyn-Werner-Wunderlich syndrome. Int J Gynaecol Obstet 2013; 121: 173
Dorit Schöller, Katharina Rall, Sara Brucker: Fehlbildungen des weiblichen Genitale, Gynäkologe 2016 49: 865–878
Nora Holtmann, Franziska Stevens, Thomas Katzorke Uterine Fehlbildungen bei Kinderwunschpatientinnen, Gynäkologie + Geburtshilfe 2016; 21 (6)
Klinische Embryologie – Organentwicklung Bildgebende Verfahren in der Pränataldiagnostik
(begleitend zur Vorlesung von Christof Worda)
Christof Worda, Katharina Walch
Eine Ultraschalluntersuchung im ersten Trimenon wird primär zur Klärung folgender Fragen durchgeführt:
■Ist die Patientin schwanger?
■Handelt es sich um eine intrauterine oder um eine extrauterine (beispielsweise im Bereich der Eileiter gelegene) Schwangerschaft?
■Ist die Schwangerschaft intakt? (Lässt sich eine fetale Herzaktion nachweisen?)
■Wie viele Embryonen kommen zur Darstellung? (Handelt es sich um eine Einlings- oder um eine Mehrlingsgravidität?)
■Wo liegt die Plazenta? Liegt eine Plazentationsstörung oder ein retroplazentares Hämatom vor?
■Muss das rechnerisch ermittelte (erster Tag der letzten normalen Regel) Gestationsalter durch das sonografisch ermittelte (Scheitel-Steiß-Länge = SSL, Abstand zwischen dem äußeren Ende des kranialen Pols bis zur äußeren Begrenzung des kaudalen Pols ohne untere Extremität, Messung nach Einstellung des Feten im Longitudinalschnitt = immer genauer in Bezug auf Berechnung des Geburtstermins) korrigiert werden?
Bis ca. zur 10. Schwangerschaftswoche (SSW) – stark abhängig von der Lage des Feten und mütterlicher Adipositas – ist die Transvaginalsonografie der transabdominellen Darstellung des Feten überlegen. Eine positive Herzaktion zeigt sich im Ultraschall ab der SSW 6/7.
Tab. 1. Gestationsalter (SSW) und Scheitel-Steiß-Länge (SSL) in mm; aus: Lehrbuch der Frauenheilkunde, Bd. 2 Geburtshilfe, Maudrich Verlag
| SSW + T | SSL (mm) |
| 5 + 0 | 3 |
| 6 + 0 | 6 |
| 7 + 0 | 10 |
| 8 + 0 | 16 |
| 9 + 0 | 23 |
| 10 + 0 | 31,5 |
| 11 + 0 | 41,5 |
| 12 + 0 | 53 |
| 13 + 0 | 66 |
| 14 + 0 | 80 |
In Bezug auf Mehrlingsgraviditäten erfolgt die Differenzierung hinsichtlich Chorionizität (Anzahl der Plazenten: mono-, di-, trichorial etc.) und der Amnionizität (Anzahl der Amnionhöhlen: mono-, di-, triamnial etc.) am zuverlässigsten am Ende des 1. Trimenon: bei dichorialen Schwangerschaften finden sich 2 getrennte Fruchtsäcke (Lambda-Sign), bei monochorialen Gemini eine gemeinsame Chorionhöhle (ein Fruchtsack) mit 2 Amnionhöhlen (diamnial) oder lediglich eine gemeinsamen Amnionhöhle (monochorial-monoamnial). Die Inzidenz von Mehrlingen beträgt 1:85 Lebendgeburten, wobei die perinatale Mortalität mit 10–14 % um das 5- bis 10-Fache im Vergleich zu einer Einlingsgravidität erhöht ist (am niedrigsten bei dichorial-diamnioten Gemini, am höchsten bei monochorial-monoamnioten Gemini). Die gezielte sonografische Diagnostik kann durch frühzeitiges Erkennen spezifischer Komplikationen bei Zwillingen und höhergradigen Mehrlingen wesentlich zur Senkung der Morbidität und Mortalität beitragen.
In der SSW 11–14 (SSL 45–84 mm) findet das sog. First-Trimester- oder Nackendicke/ transparenz-Screening statt. Die Nackentransparenz ist das sonografische Erscheinungsbild einer kutanen Flüssigkeitsansammlung im Bereich des fetalen Nackens im ersten Schwangerschaftstrimenon, welche sich üblicherweise im zweiten Trimenon wieder auflöst. Ein Nackenödem (Nackentransparenz, NT) findet sich physiologischerweise bei allen Feten in o. g. SSW und beträgt im Mittel 1–3 mm (ansteigend mit der SSL). Je größer die NT ist, desto größer ist das Risiko für Chromosomenanomalien (v. a. Trisomie 21, aber auch Trisomie 13, Trisomie 18, TurnerSyndrom, Triploidie), Herzfehler und diverse komplexe Fehlbildungssyndrome. Typischerweise wird das NT-Screening durchgeführt, um ein individuelles Risiko für eine fetale Trisomie 21 aus mütterlichem Alter (das Risiko steigt mit zunehmendem mütterlichen Alter exponentiell an), Nackendicke und SSL/Schwangerschaftswoche im konkreten Einzelfall zu ermitteln und dem betroffenen Paar – abhängig vom jeweiligen Risiko – die Entscheidung pro oder kontra invasiver Diagnostik (Amniozentese – Fruchtwasserpunktion ab SSW 15, Chorionzottenbiopsie – Plazentapunktion in SSW 10–12) zu erleichtern. Diese Form des „genetischen“ Ultraschalls zielt auf eine möglichst exakte Einschätzung des individuellen Risikos einer fetalen Chromosomenaberration ab, ohne primär invasiv vorzugehen, da eine invasive Diagnostik mit einer durchschnittlichen Komplikationsrate von 1:200 bis 1:300 (Blasensprung, Fehlgeburt, Wehen, Blutungen) einhergeht. Dieses Risiko muss gegen den potenziellen Nutzen der Punktion (sicherer Chromosomenbefund durch Karyotypisierung) abgewogen werden, wobei der „genetische Ultraschall“ dazu dienen soll, die Risiko-Nutzen-Relation für den Einzelfall genau einzugrenzen. Wichtig sind hier die ausführliche Aufklärung des Paares und die gemeinsame Entscheidungsfindung. Das Paar soll verstehen, dass das Ergebnis der NT-Messung eine Wahrscheinlichkeit angibt (z. B. 1:1.800), aber nur eine invasive Diagnostik Gewissheit darüber geben kann, ob man die eine Betroffene der 1.800 Frauen ist. Ist das errechnete Risiko einer genetisch bedingten Fehlbildung größer als > 1:100, wird man in der Regel zu einer weiteren invasiven Abklärung raten.
Es beginnt sich auch der Einsatz der zellfreien fetalen DNA (cfDNA) als „non invasive prenatal testing“ (NIPT) als Screeningmethode für Chromosomenanomalien zu etablieren. Ca. 5–15 % der freien DNA im mütterlichen Plasma ist fetalen Ursprungs – freigesetzt von der Plazenta. Um Merkmale wie eine Trisomie 21 zu erkennen, kommen zur Zeit zwei Ansätze zur Anwendung: Beim „massively parallel sequencing“ werden alle DNA-Fragmente ausgewertet, wogegen beim „targeted“ auf ganz spezifische Fragmente zurückgegriffen wird. Damit sind Detektionsraten von über 99 % bei einer falsch positiv Rate von weniger als 0,1 % für Trisomie 21 möglich und dadurch müssen deutlich weniger Punktionen durchgeführt werden. Die Screeningdaten für Trisomie 18 und 13 sind etwas schlechter. In naher Zukunft werden möglicherweise kleinere chromosomale Veränderungen im Rahmen eines Screenings mit diesen Methoden aufzudecken zu sein.
Tab. 2. Altersabhängiges Risiko zwischen SSW 15 und 20 für das Vorliegen einer Trisomie 21; aus: Lehrbuch der Frauenheilkunde, Bd. 2: Geburtshilfe, Maudrich Verlag
| Alter (Jahre) | Risiko |
| 18 | 1:1.201 |
| 25 | 1:1.024 |
| 30 | 1:664 |
| 35 | 1:269 |
| 40 | 1:77 |
| 45 | 1:19 |
| 50 | 1:4 |
75 % der Feten mit Trisomie 21 haben eine erhöhte Nackentransparenz (nicht alle!). Die Detektionsrate für Trisomie 21 beträgt 30 %, wenn man sich im Rahmen des Screenings ausschließlich auf das mütterliche Alter bezieht („Altersindikation“ bei Frauen > 35 Jahre), 70–80 %, wenn neben dem Alter auch die fetale Nackentransparenz berücksichtigt wird, und 95 % bei einem Screening, welches mütterliches Alter, fetale NT und Nasenbein (60–70 % der Feten mit Trisomie 21 haben in SSW 11–14 noch kein ultrasonografisch darstellbares, verknöchertes Nasenbein) sowie mütterliche Serumkonzentrationen feto-plazentarer Produkte (z. B. freies ß-hCG, PAPP-A, AFP, E3). Unter Tripel-Diagnostik (Serummarkerscreening) versteht man dabei die Berechnung des individuellen Risikos einer schwangeren Frau, ein Kind mit Chromosomenstörung (vornehmlich einem Down-Syndrom, welches ja – im Gegensatz zu vielen anderen Fehlbildungen und in Abhängigkeit vom Ausprägungsgrad – prinzipiell mit dem Leben vereinbar ist) zu gebären. Neben einer exakten Ultraschallbiometrie (inkl. NT-Messung, s. o.) werden beim Tripeltest in erster Linie AFP, ß-hCG und E3 aus dem mütterlichen Serum (zwischen SSW 16 – spätestens SSW 21) zur Risikoberechnung herangezogen. Auch hier ist wieder die Information über die Aussagekraft sowie die fachkundige Interpretation und Information hinsichtlich des Ergebnisses essenziell.
Fehlbildungen, welche bereits beim First-Trimester Screening ultrasonografisch erkannt werden können, sind z. B.:
■Anenzephalus: schwerste Fehlbildung eines Neuralrohrdefekts (NRD), entsteht vor dem 26. Tag der Schwangerschaft, Schädeldecke hat sich nicht geschlossen und es fehlen in unterschiedlichem Umfang Teile des knöchernen Schädeldaches, der Hirnhäute, der Kopfhaut und des Gehirns; Vorkommen selten im Zusammenhang mit Chromosomenaberrationen; erhöhtes Risiko bei maternaler Einnahme von Antikonvulsiva, Folsäuremangel, Diabetes mellitus; Verlauf immer letal
■Amelie: angeborenes Fehlen einer oder mehrerer Gliedmaßen
■Hydrops/Hygroma colli: vermehrtes Auftreten von Wasser bzw. seröser Flüssigkeit in vorgebildeten Hohlräumen (in schwerster Ausprägung: hydrops fetalis universalis) bzw. vermehrte Flüssigkeitsansammlung im Bereich des fetalen Halses (gilt auch als sonografischer Softmarker für diverse chromosomal bedingte Fehlbildungen)
■Zwillingsfehlbildungen (z. B. fehlerhafte Aufspaltung des frühen Embryos bei eineiigen Zwillingen und ungleiche Verteilung unpaarer Organe)
■evtl. kongenitale Vitien, Zwerchfellhernien, Bauchwanddefekte und andere Fehlbildungen – in Abhängigkeit von der Ausprägung
Eine medizinisch indizierte Abruptio zu diesem Zeitpunkt kann immer nur nach Vorliegen eines auffälligen Chromosomenbefundes und/oder schwerer somatischer Fehlbildung durchgeführt werden, nie aufgrund einer erhöhten NT im Ultraschall (diese dient nur als sonografischer Hinweis darauf, dass „etwas nicht in Ordnung ist“, aber es gibt auch völlig „gesunde“ Feten mit erhöhter NT). Bei Vorliegen einer nachgewiesenen Chromosomenaberration wird dem Paar sowohl bei Entschluss zur Schwangerschaftsbeendigung, als auch zur Fortführung der Schwangerschaft eine psychologische Begleitung angeboten/nahe gelegt. Feten mit chromosomalen Anomalien, welche nach der Geburt (v. a. in einer Schwangerschaftswoche > 20) Lebenszeichen zeigen, werden in der Regel mit „comfort care“ versorgt – das Neugeborene kann (bei entsprechendem Wunsch und der Bereitschaft dazu) von der Mutter im Arm gehalten werden und es wird versucht, schmerzfreie Minuten/Stunden zu ermöglichen (Wärmezufuhr, Analgetika). Alternativ wird den Kindeseltern bei potenziell lebensfähigem Feten (fortgeschrittene Schwangerschaftswoche) auch ein intrauteriner Fetozid vor Einleitung der Geburt angeboten. Generell ist natürlich bei Vorliegen einer chromosomal bedingten Fehlbildung eine möglichst frühzeitig gestellte sichere Diagnose anzustreben. Dadurch hat das Paar zur Informations- und Entscheidungsfindung mehr Zeit und der Fet nach Schwangerschaftsbeendigung in einer frühen SSW zeigt noch keine Lebenszeichen, sodass die Situation sowohl psychisch als auch physisch weniger belastend ist.
In den letzten Jahren hat sich in einigen Krankenhäusern mit dem Schwerpunkt fetomaternale Medizin eine sog. „genetische Beratung“ etabliert.
Hier wird das Paar in Bezug auf das prozentuelle Wiederholungsrisiko von Erbkrankheiten (für welche einer der Betroffenen selbst oder ein Familienmitglied) Merkmalsträger ist oder von De-novo-Mutationen in einer vorangegangenen Schwangerschaft (z. B. mit fetaler Trisomie) aufgeklärt.
Im 2. Trimenon steht zunächst die biometrische Wachstumskontrolle des Feten im Vordergrund. Das Gewicht des Feten (die Länge spielt nun eine untergeordnete Rolle) wird durch Messung des Kopfumfanges (Biparietaler Durchmesser = BIP und frontookzipitaler Durchmesser = FOD), des Abdomenumfanges (AU) und der Femurlänge (FL) ermittelt und häufig in Form von Perzentilen angegeben. Wichtig ist weiters die Ermittlung der Fruchtwassermenge (normal, verminderte Fruchtwassermenge, Oligo-/Anhydramnion, vermehrte Fruchtwassermenge, Polyhydramnion) und die neuerliche Überprüfung der Plazenta – in Bezug auf deren Lokalisation (liegt die Plazenta z. B. gänzlich vor dem inneren Muttermund, spricht man von einer Placenta praevia, welche sich im fortgeschrittenen Gestationsalter häufig durch vaginale Blutungen äußert und in 1:200 Fällen auftritt; das Kind muss per Kaiserschnitt entbunden werden) und Funktion (Doppler-Blutflussmessung der fetalen Nabelschnur und ggf. der fetalen A. cerebri media). Beim Screening im 2. Trimester (sog. Organscreening/Fehlbildungsscreening) in SSW 19–22 findet eine exakte Beurteilung folgender fetaler Strukturen und die gezielte Suche nach allfälligen fetalen Fehlbildungen statt (Beispiele für mögliche Fehlbildungen sind jeweils in Klammer angeführt):
■Kopf: ZNS (Neuralrohrdefekte-An-/Exenzephalie, Hydrozephalus, intrazerebrale Blutungen, Zysten, Holoprosenzephalie, Corpus-callosum-Agenesie ...) und Gesicht (Lippen-Kiefer-Gaumenspalte)
■Hals (Halszysten, Hygroma colli: bedingt durch Lymphabflussstörung, ggf. Hinweiszeichen auf chromosomale Aberrationen)
■Thorax: Herz (Septumdefekt-Vitien, Fallot’sche Tetralogie → bei Herzfehlbildungen zu 35 % Chromosomenaberrationen), Lunge (Hypoplasie, Sequestration, Pleuraerguss-Hydrothorax), Zwerchfell (Hernie → 20 % Trisomie 18, häufig kardiale Begleitfehlbildungen)
■Abdomen: Magen (Obstruktive Fehlbildungen – Ösophagus-/Duodenalatresie → bei kombiniertem Auftreten mgl. Hinweis auf Trisomie 21), Bauchwand (Omphalozele → häufig zusätzliche Fehlbildungen, Gastroschisis), Niere (zystische Nierendysplasie, Hydronephrose, Anomalie in Lage und/oder Form → bei Nachweis zusätzlicher Fehlbildungen Aneuploidierisiko von 30 %), Harnblase (Doppelfehlbildungen im harnableitenden System)
■Wirbelsäule (Meningomyelozele, Spina bifida → mögliche Assoziation mit Trisomie 13/18, Triploidie), Steißbein (Teratom)
■Extremitäten (Dysplasien, Deformitäten-Klumpfüße, Fehlhaltungen, Spaltfüße, -hände, Poly-, Syndaktylie)
Beim Vorliegen sog. indirekter Hinweiszeichen auf chromosomale Fehlbildungen stellt sich die Indikation zur invasiven Diagnostik (s. o.) – wobei die Entscheidung pro oder kontra immer den betroffenen Kindseltern zukommt und der pränatal diagnostisch tätige Arzt lediglich aufklärende und beratende Funktion einnimmt. Zu den wichtigsten Hinweiszeichen für Fehlbildungen zählen dabei Abweichungen von der normalen Fruchtwassermenge, fetale Retardierung, Auffälligkeiten des fetalen Körperumrissbildes bzw. der Körperoberfläche, fetale Strukturanomalien bzw. Auffälligkeiten im Körperinneren und Dysproportionen der fetalen Körperregionen zueinander (z. B. Zwergwuchsformen, Mikrozephalus etc.). Ergänzend zur 2D-Ultrasonografie kann hier eine mehrdimensionale Sonografie (3D–5D) je nach Fragestellung einen relevanten Informationsgewinn liefern. In den letzten Jahren hat sich zur Klärung spezifischer Fragestellungen (z. B. Lungenvolumetrie, Schweregrad einer Fehlbildung – z. B. eines Bauchwand- oder Neuralrohrdefektes) auch das fetale MRT etabliert.
Im 3. Trimenon, in welchem die Organreifung fortgesetzt und beendet wird, spielen wiederum die fetale Biometrie (kontinuierliches Wachstum entlang der Perzentilen? Gewichtsschätzung anhand von BIP, AU und FL; Diagnose von Wachstumsstörungen), die Beurteilung der Fruchtwassermenge und der Plazenta eine wichtige Rolle, wobei die Plazenta mit zunehmender Schwangerschaftsdauer und in Abhängigkeit vom mütterlichen Nikotinkonsum Reifezeichen aufweist (Verkalkungen, im Ultraschall als echodichte „Sprenkel“ zu sehen).
Als Indikationen für die Durchführung einer Dopplersonografie zählen:
■Verdacht auf intrauterine Wachstumsretardierung (= IUGR; ggf. bedingt durch Plazentainsuffizienz mit Mangelversorgung des ungeborenen Kindes)
Details
- Seiten
- 298
- ISBN (ePUB)
- 9783991118206
- Sprache
- Deutsch
- Erscheinungsdatum
- 2023 (Dezember)
- Schlagworte
- Schwangerschaft Gynäkologie Sterilitätsbehandlung Sexualmedizin Klinik der Regelkreise klinische Endokrinologie Reproduktionsmedizin Embryonale Entwicklung Reproduktion Christian Dadak Psychologie der Geschlechtsorgane Organentwicklung Geburt Sexualität und Psychosomatik Ethische Probleme Sexualität

