Zusammenfassung
Rheumatoide Arthritis ist eine chronisch entzündliche Erkrankung, die rund 1 von 100 Erwachsenen im deutschsprachigen Raum betrifft. Schmerzen und Bewegungseinschränkungen sind häufig – eine massive Belastung, die oft Appetitlosigkeit und Muskelabbau zur Folge hat.
In diesem Buch erfahren Sie, wie Sie Ihrem Körper über die Ernährung Gutes tun und wieder Freude am Essen finden.
• Was Sie über Rheumatoide Arthritis wissen sollten
• Welche Lebensmittel die Symptome lindern können
• Begleiterscheinungen wie Unverträglichkeiten oder Muskelschwund begegnen
• Einfache und schmackhafte Rezepte
• Gratis Einkaufslisten-App
Leseprobe
Inhaltsverzeichnis
- COVER
- TITLE SEITE
- IMPRESSUM
- INHALTSVERZEICHNIS
- VORWORT
- RHEUMA: BEGRIFF UND ERKRANKUNG
- HÄUFIGKEIT
- KRANKHEITSURSACHE UND KRANKHEITSENTSTEHUNG
- DAS KRANKHEITSBILD
- THERAPIEMÖGLICHKEITEN
- BEGLEITERKRANKUNGEN DER RHEUMATOIDEN ARTHRITIS
- ERNÄHRUNG BEI RHEUMATOIDER ARTHRITIS
- EINFLUSSNAHME VON ERNÄHRUNG AUF DAS ENTZÜNDUNGSGESCHEHEN
- ENTZÜNDUNGSREAKTIONEN DURCH OPTIMALE ANTIOXIDANTIEN KONTROLLIEREN
- SIND NAHRUNGSERGÄNZUNGSMITTEL NOTWENDIG?
- KANN FASTEN HELFEN?
- ERNÄHRUNG BEI BEGLEITERSCHEINUNGEN
- UMSETZUNG IN DER PRAXIS
- TIPPS FÜR DAS ESSEN AUSSER HAUS
- ESSVERHALTEN
- ZUSAMMENFASSUNG DER WICHTIGSTEN PUNKTE
- REZEPTE
- TIPPS FÜR DIE ZUBEREITUNG
- SUPPEN
- KLEINE SPEISEN
- SHAKES
- VEGETARISCHE HAUPTGERICHTE
- HAUPTGERICHTE MIT FISCH
- HAUPTGERICHTE MIT FLEISCH
- SÜSSES
- KLEINES KÜCHENLEXIKON
- ABKÜRZUNGEN
- REZEPTVERZEICHNIS
- LITERATURVERZEICHNIS
- ANZEIGEN
VORWORT

Rheumatoide Arthritis gehört zu den chronisch entzündlichen Erkrankungen. Sie geht meist mit Schmerzen und Bewegungseinschränkungen einher – eine massive Belastung für Betroffene. Vielleicht haben Sie im Internet schon ein wenig recherchiert, wie die Ernährung helfen könnte. Diäten sind jedoch meist sehr einseitig und nicht zu empfehlen. Es gibt zwar keine spezielle Rheuma-Ernährung, wir können mit dem, was wir essen, allerdings Einfluss auf das Entzündungsgeschehen nehmen.
In diesem Ratgeber erfahren Sie wichtige Eckdaten zur Erkrankung, welche Therapieformen hilfreich sein können und wie die Ernährung unterstützen kann. Das Fettsäuremuster ist maßgebend für die Bildung und Hemmung von Entzündungsfaktoren. Tierische Fette sind eher ungeeignet, es geht hier also in Richtung pflanzenbasierter Kost. Außerdem lernen Sie, wie Antioxidantien das Entzündungsgeschehen hemmen können. Durch die chronische Entzündung und die nötigen Medikamente besteht ein erhöhtes Risiko für Osteoporose. Ein Überblick der kalziumreichsten Lebensmittel hilft dabei, dieser vorzubeugen. Durch den Schmerz tritt häufig Appetitlosigkeit auf, womit das Risiko für einen Muskelabbau steigt. Lesen Sie Tipps, wie Sie Ihre Esslust wieder steigern können und wie Sie trotz Appetitlosigkeit Ihren Energie- und Nährstoffbedarf decken können. Eiweiß spielt hierbei die zentrale Rolle. Es werden pflanzliche Eiweißquellen ins Visier genommen. Nahrungsmittelunverträglichkeiten kommen bei Betroffenen mit Rheumatoider Arthritis häufiger vor. Sie erhalten einen Überblick zu den drei wichtigsten Nahrungsmittelunverträglichkeiten. Am Ende stehen noch viele praktische Tipps, wie Sie die Empfehlungen am besten umsetzen können – sowohl bei den Mahlzeiten als auch beim generellen Essverhalten. Die Rezepte sind vorwiegend vegetarisch und aus internationaler Küche, um Ihnen einen Blick über den Tellerrand zu ermöglichen. Sie finden geschmackvolle Anregungen, wie Sie Ihrem Körper etwas Gutes tun und wieder Freude am Essen finden.
Viel Vergnügen beim Lesen, Ausprobieren und Kochen!
RHEUMA: BEGRIFF UND ERKRANKUNG
Unter Rheumatismus versteht man landläufig Beschwerden aufgrund von fließenden, reißenden oder ziehenden Schmerzen im Bewegungsapparat. Das Wort „Rheuma“ kommt aus dem Altgriechischen (ῥεũμα) und bedeutet so viel wie „Strömung, Strahl“. Hinter dem Überbegriff „Rheuma“ verbergen sich mehr als 400 verschiedene, zum Teil sehr seltene Krankheiten, die je nach Krankheitsbild in allen Altersgruppen auftreten können. Somit ist „Rheuma“ nicht unbedingt ein Phänomen des Alters. Die rheumatischen Erkrankungen verursachen Beschwerden im Stütz- und Bewegungsapparat und befallen meist Gelenke und Knochen sowie Muskeln, Sehnen und deren Anhangsgebilde (Sehnenscheiden, Schleimbeutel). Es gibt aber auch Krankheitsbilder, die verschiedene innere Organe oder sogar die Haut betreffen.
Im klassischen Sinne verstehen die meisten Menschen unter „Rheuma“ chronischen Schmerz im Bewegungsapparat und insbesondere in den Gelenken. Die Ursachen können dabei vielfältig sein. Wir unterscheiden degenerative Gelenkerkrankungen von entzündlichen Formen (sogenannte Arthritiden – Einzahl: Arthritis). Eine Übersicht dazu gibt Tabelle 1 (S. 10).
Abbildung 1: Arthritisches Gelenk
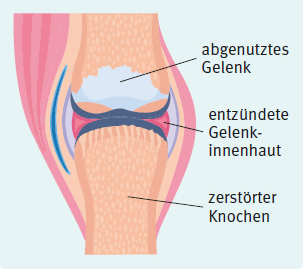
Ein klassisches Beispiel ist die Gicht, bei der es durch die Ablagerung von Harnsäurekristallen in den Gelenken zu einer Entzündungsreaktion kommt. Die häufigste entzündliche Gelenkerkrankung im Erwachsenenalter ist jedoch die Rheumatoide Arthritis (RA), früher auch als (primär) chronische Polyarthritis (PcP) bezeichnet. Die Erkrankung verläuft chronisch und in Schüben und führt unbehandelt zu irreversiblen Schäden in den Gelenken. Sie wurde erstmals 1800 von A. J. Landré-Beauvais beschrieben.
Tabelle 1: Ursachen rheumatischer Erkrankungen
| Krankheitsbild | Charakteristika |
| Entzündliche Gelenkerkrankungen | |
| Rheumatoide Arthritis (RA) | v. a. Hand-, Finger-, Fußgelenke; positive „Rheuma-Serologie“ Rheumafaktor (~ 75 %)sog. anti-CCP-Antikörper (~ 50–60 %) |
| Spondylarthritis (SpA)
•axiale SpA (früher M. Bechterew) •periphere SpA 1.Psoriasis-Arthritis 2.Reaktive Arthritis 3.Arthritis bei entzündlichen Darmerkrankungen |
•Arthritis in der LWS, Darm-Kreuzbein-Gelenk •Arthritis anderer Gelenke 1.mit Schuppenflechte 2.nach Harnröhren- oder Magen-Darm-Infekten 3.bei Morbus Crohn, Colitis ulcerosa |
| Polymyalgia rheumatica | |
| Kristallarthropathie
•Arthritis urica (Gicht) •Chondrokalzinose („Pseudogicht“) |
durch Ablagerung von Kristallen im Gelenk
•Harnsäurekristalle •Calciumpyrophospat-Kristalle |
| Kollagenosen (Bindegewebserkrankungen) | |
| Systemischer Lupus erythematodes (SLE) Sklerodermie, Polymyositis/Dermatomyositis, Sjögren-Syndrom, Sharp-Syndrom (Mischkollagenose), Antiphospholipid-Syndrom |
Laborbefund sog. Antinukleäre Antikörper (ANA) positiv; je nach Schweregrad Entzündungen in Haut oder Organen (Niere, Lunge, Gelenke, Gehirn, Muskeln); Blutbildveränderungen, Thrombosen |
| Vaskulitiden (Gefäßentzündungen) | |
| Riesenzell-Arteriitis, Takayasu-Arteriitis, Formen der Polyangiitis, Kawasaki-Syndrom, Morbus Behcet, Goodpasture-Syndrom u. a. m. | Befall verschiedener Organsysteme mit sehr unterschiedlichem Schweregrad: Haut, Niere, Lunge, Nasennebenhöhlen, Augen, Gehirn |
| Degenerative Gelenkerkrankungen | |
| Arthrose | Finger (Heberden/Bouchard-Arthrosen), Daumen (Rhizarthrose), Wirbelsäule (Spondylarthrose), Knie (Gonarthrose), Hüfte (Coxarthrose), Schulter (Omarthrose) |
Zirka 0,5 bis 1 % der mitteleuropäischen Bevölkerung leiden an einer RA. Die Erkrankung zeigt hinsichtlich der Altersverteilung zwei Gipfel: Der erste liegt in der 3.–4. Lebensdekade, ein zweiter Anstieg ist ab dem 60. Lebensjahr zu beobachten. Zwei Drittel der Betroffenen sind Frauen.
Krankheitsursache und Krankheitsentstehung
Die genauen Ursachen, welche eine RA auslösen, sind nicht vollständig geklärt. Man kennt mittlerweile jedoch verschiedene Risikofaktoren, welche die Entstehung der Krankheit begünstigen. Zudem weiß man sehr viel über die Prozesse, die bei der Entzündungsreaktion ablaufen, wenn die Krankheit einmal ausgebrochen ist. Aus diesem Wissen haben sich mittlerweile viele verschiedene therapeutische Ansätze in der modernen Medizin ergeben, mit denen die Erkrankungsaktivität sehr gut kontrolliert und bei vielen Patient:innen auch zum Stillstand (in die sogenannte Remission) gebracht werden kann.
Offensichtlich begünstigen bestimmte genetische Faktoren die Entstehung einer RA. Dazu zählen jene Merkmale, die unsere Körperzellen und unser Gewebe typisieren, der sogenannte Histokompatibilitätskomplex (MHC). Diese Eigenschaften werden, ähnlich den Blutgruppen, vererbt und im sogenannten HLA-System (Humanes Leukozyten-Antigen) eingeteilt. Unter der Vielzahl der dabei entstehenden Möglichkeiten ist eine Assoziation der RA mit Varianten des sogenannten HLA-DRB1-Gens nachgewiesen. Dieses genetische Risiko trägt aber nur bei 30 bis 50 % zur Entstehung der Erkrankung bei. Menschen mit diesem Gentypus (Allel) haben ein 2- bis 3-fach höheres Risiko an einer RA zu erkranken als Menschen mit einem anderen HLA-Typ. In einer Untersuchung unter eineiigen (genetisch identen) Zwillingen hat man beobachtet, dass bei Erkrankung eines der beiden Geschwister in 15–30 % der Fälle die zweite Person ebenfalls eine RA entwickelte. Damit muss es über das genetische Risiko hinaus jedenfalls noch andere Faktoren geben, die zur Entstehung und Auslösung einer Erkrankung beitragen. Diese können sehr vielschichtig sein und dürften von Umwelteinflüssen bis hin zu Infektionen mit Viren oder Bakterien reichen, die letztlich beim zufälligen Zusammentreffen diese chronische Entzündung auslösen. Es wurden beispielsweise vermehrt RA-Fälle nach einer Parodontitis (Zahnfleischentzündung) beschrieben. Auch der Lebensstil hat einen Einfluss, Raucher:innen haben ein rund 40 % höheres Risiko, an einer RA zu erkranken. Zudem erleiden sie auch meist einen aggressiveren Verlauf der Arthritis. Möglicherweise spielt auch die Darmflora eine Rolle bei der Entstehung.
Bei der RA handelt es sich um eine sogenannte Autoimmunreaktion. Dabei kommt es zu einer Art Fehlsteuerung im Immunsystem, wodurch in den Gelenken und den angrenzenden Strukturen eine Entzündung in Gang gesetzt wird, obwohl es dafür keinen Grund gibt. Normalerweise löst das Immunsystem eine Entzündungsreaktion zur Abwehr von Infektionen mit Viren, Bakterien oder anderen Krankheitserregern aus. Im Falle der RA werden körpereigene Gewebeanteile in den Gelenken fälschlich als fremd erkannt und damit wird gegen diese eine immunologische Reaktion gestartet. Da das Immunsystem über ein Gedächtnis verfügt, bleibt diese Fehlprogrammierung erhalten und die Erkrankung verläuft chronisch.
Moderne Medikamente geben uns zwar die Möglichkeit, die Krankheit zu stoppen, wir können die RA aber noch nicht heilen.
Die immunologischen Mechanismen sind vielfältig und sehr komplex, es kommt zum Zusammenspiel der verschiedensten Immunzellen (T-Lymphozyten, B-Lymphozyten, Makrophagen und anderen sogenannten antigenpräsentierenden Zellen, Granulozyten u. a. m.). Dabei werden von diesen auch zahlreiche Botenstoffe gebildet, sogenannte proinflammatorische Zytokine, die ihrerseits den Entzündungsvorgang verstärken. Von diesen Botenstoffen sind mittlerweile einige identifiziert, die gezielte Neutralisation dieser Zytokine ist heute ein wesentlicher Therapieansatz bei der Behandlung der RA.
Grundsätzlich kann jedes Gelenk im Rahmen einer RA von einer Entzündung betroffen sein. Typischerweise ist es aber der Befall der Finger- und Handgelenke bzw. der Zehengelenke, meist symmetrisch, also an beiden Händen und/oder Füßen, der zu typischen Krankheitsbildern mit durch die Gelenkschädigung entstehenden Fehlstellungen führt.
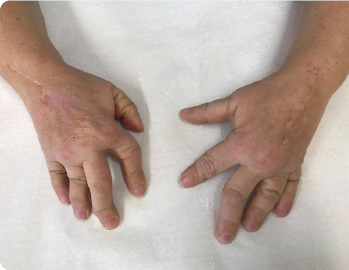
RA nach jahrzehntelanger Dauer. Aufgrund moderner Therapieansätze können solche Verläufe heute meist verhindert werden.
Die Beschwerden beginnen schleichend mit Schmerzen und dem Gefühl der Steifigkeit in den Fingergelenken, meist ausgeprägter in den Morgenstunden. Oft äußert sich dies durch ein Faustschlussdefizit. Frühmorgens ist die entzündliche Aktivität meist höher, die Beschwerden bessern sich dann tagsüber etwas. Zu Beginn der Erkrankung sind Schwellungen kaum sichtbar, betroffene Frauen bemerken aber oft, dass sie Ringschmuck nicht mehr anstecken oder abnehmen können. Die Beschwerden sind es, welche die Patient:innen dann zum Arzt bzw. zur Ärztin führen. Bei den Laboruntersuchungen können erhöhte Entzündungswerte (Blutsenkungsgeschwindigkeit, C-reaktives Protein) sowie erhöhte Rheumafaktoren (RF) und/oder sogenannte Antikörper gegen citrullinierte Peptide (anti-CCP/ACPA) gefunden werden. Zu Beginn der Erkrankungen weist jedoch nur die Hälfte der Betroffenen positive Rheumafaktoren auf, im Laufe der Erkrankung sind es dann letztlich ca. 75 %. Das bedeutet im Umkehrschluss, dass dieses Krankheitsbild trotz negativer immunologischer Befunde vorliegen und diagnostiziert werden kann. Die Diagnosestellung richtet sich in erster Linie nach dem Befallsmuster, dem sogenannten klinischen Bild. Wir wissen aber, dass Betroffene, bei denen Rheumafaktor und/oder anti-CCP-Antikörper nachweisbar sind, einen aggressiveren Krankheitsverlauf aufweisen. Damit ist das Risiko für Gelenkschäden höher als bei einer sogenannten „seronegativen“ RA.
Die Diagnose wird vorwiegend durch das Beschwerdebild gestellt, Laboruntersuchungen und bildgebende Verfahren (Röntgen, Ultraschall, eventuell Magnetresonanztomographie/MRT) sind ergänzende Untersuchungen.
Unbehandelt führt die RA innerhalb weniger Jahre zu ausgeprägten Gelenkzerstörungen, die neben den chronischen Schmerzen zu entsprechenden Funktionseinbußen bis hin zur Behinderung führen können. Die Erkrankung kann sich auch auf viele Gelenke ausdehnen, daher der früher gebräuchliche Name „Polyarthritis“. Sogar das Kiefergelenk kann in Mitleidenschaft gezogen werden, was zu starken Schmerzen beim Kauen bis hin zu Kiefersperren führen kann.
Als Komplikation der RA ist eine Entzündung im Bereich der Halswirbelsäule gefürchtet, die zur Instabilität insbesondere zwischen dem 1. und 2. Halswirbelkörper führen kann. Eine Folge daraus kann eine hohe Querschnittslähmung oder gar der plötzliche Tod durch eine Art Genickbruch sein. Daher ist es insbesondere bei langjährig bestehender Erkrankung wichtig, auch diese Skelettabschnitte radiologisch zu kontrollieren.
Wie grundsätzlich in der Medizin unterscheiden wir zwischen nicht-medikamentösen und medikamentösen Therapieansätzen. Beide sind immer in Kombination unerlässlich, um Krankheitsfolgen zu verhindern und die Lebensqualität bestmöglich zu erhalten. Neben Schmerzfreiheit und Stillstand der Entzündung sind natürlich der Erhalt der Gelenke und ihrer Funktionalität die obersten Ziele.

Medikamentöse Therapien
Wir unterscheiden zum einen die Gruppe der schmerzlindernden (analgetischen) Medikamente mit keiner oder geringer entzündungshemmender Wirkung, die vor allem die nicht-steroidalen Rheumatika (NSAR) umfassen. Daneben sind nach wie vor Corticosteroide („Cortison“) unverzichtbar in der raschen Behandlung von akuten entzündlichen Schüben. Die dritte und wichtigste Säule der medikamentösen Therapie bilden die sogenannten krankheitsmodulierenden Medikamente (auch Basistherapie oder DMARDs genannt, aus dem engl. Disease Modifying Antirheumatic Drugs), die durch ihre starke entzündungshemmende Wirkung die Arthritis im günstigsten Fall zum Stillstand bringen und letztlich auch keine Einnahme von Cortison mehr erforderlich machen. Unter diesen krankheitsmodulierenden Medikamenten unterscheiden wir sogenannte konventionelle Therapien von den neu als zielgerichtete Therapie entwickelten Biologica. Diese biotechnologisch hergestellten Substanzen neutralisieren die zuvor genannten, im Entündungsprozess zentralen proinflammatorischen Zytokine oder eliminieren Entzündungszellen und unterbrechen so den Entzündungsprozess und stoppen die Arthritis. Einen neuen Ansatz stellen die sogenannten Janus-Kinase-Hemmer (JAKibs) dar. Diese Medikamente sind kleine Moleküle („small molecules“), welche in die Immunzellen eindringen und dort Signalwege unterbrechen, die zur Aktivierung der Entzündungsreaktion führen würden.
In Tabelle 2 sind die derzeit verfügbaren Basistherapien (DMARDs) zusammengefasst.
Tabelle 2: DMARDs
| Konventionelle Basistherapien/DMARDs Methotrexat, Sulfasalazin, Leflunomid (Hydroxychloroquin, Cyclosporin A) |
| „Biologicals“ (Eiweißmoleküle gegen Botenstoffe oder Zellen) Blockade der Wirkung von •Tumor-Nekrose-Faktor-α (Adalimumab, Certolizumab, Etanercept, Golimumab, Infliximab) •Interleukin-1 (Anakinra) •Interleukin-6 (Tocilizumab, Sarilumab) •T-Zellen (Abatacept) •B-Zellen (Rituximab) |
| Synthetische DMARDs, „Small molecules“ Hemmung von Janus-Kinasen (Baricitinib, Filgotinib, Tofacitinib, Upadacitinib) |
Nicht-medikamentöse Therapien
Hier sind vor allem physikalisch-therapeutische Maßnahmen zu nennen, die neben der Symptomlinderung auch funktionserhaltende Effekte haben. Insbesondere für die Hand- und Fingergelenke ist diese Art der Behandlung zur Verbesserung der alltagsrelevanten Beweglichkeit und Kraft von Bedeutung. Bewegungstherapiepläne können für alle betroffenen Gelenke erstellt werden. Natürlich hat auch bei Menschen mit Arthritis eine Sport- und Trainingstherapie eine gesundheitsfördernde Wirkung. Die übermäßige Belastung von akut entzündeten Gelenken soll zwar vermieden werden, aber grundsätzlich gilt auch hier die Regel „Leben heißt Bewegen“. Ein Training ist daher unter ärztlicher oder physiotherapeutischer Anleitung ratsam. Generell ist körperliche Betätigung mit gleichmäßigen Bewegungsformen (z. B. Nordic Walking, Radfahren, Schwimmen), ohne übermäßige Druckbelastung auf betroffene Gelenke günstig. In akuten Phasen können auch spezielle lokale Therapieformen auf einzelne Gelenke angewendet werden: etwa Kryotherapie (Kälteanwendungen), Iontophorese (Medikamente werden mit Strom unter die Haut gebracht), Ultraschall u. a. m. Darüber hinaus ist die Ergotherapie (Schienen, Hilfsmittel u. a. m.) eine weitere wesentliche Behandlungsform, um die Gelenke vor Fehlbildungen oder Überlastungen zu schützen. Insbesondere Schienen, sofern sie richtig angepasst und regelmäßig getragen werden, wirken Deformierungen entgegen und verbessern auch die Kraft. Hilfsmittel dienen auch dazu, im fortgeschrittenen Stadium die Alltagsfunktionen zu verbessern und damit die Aktivitäten des täglichen Lebens besser zu bewältigen. Sehr gute Tipps mit Videoanleitung findet man unter der Internetadresse www.gelenkschutz.at.


Viele Menschen mit jahrelanger RA und chronischen Schmerzen leiden auch unter chronischer Müdigkeit (sogenanntes Fatigue-Syndrom) oder Depressionen. Antidepressiva werden in der Medizin auch bei chronischen Schmerzzuständen eingesetzt, da diese die Schmerzschwelle im Gehirn verändern. Dies gilt für jene Situationen, in denen der Schmerz sich „verselbständigt“ hat und somit seine Funktion als Warnsignal verliert. Das Gehirn hat eine Art „Schmerzgedächtnis“. Daher sind auch bei diesen Beschwerden ergänzende psychotherapeutische und verhaltenstherapeutische Ansätze hilfreich und zielführend. Dies kann aber nicht die zur Behandlung der RA unbedingt erforderliche und oben erwähnte entzündungshemmende Basistherapie (DMARD) ersetzen.
Wenn Gelenke irreversibel geschädigt sind und schwere Funktionseinbußen und/oder therapieresistente Schmerzen bestehen, werden letztlich auch orthopädisch-chirurgische Behandlungsmöglichkeiten in Betracht gezogen (Gelenkersatz, operative Stabilisation etc.). Daraus ergibt sich natürlich, dass Übergewicht insbesondere für die gewichtstragenden Gelenke (Hüfte, Knie, Sprunggelenke, Füße) ein zusätzlich schädlicher Faktor ist. Demnach ist hier ein weiteres wichtiges Argument für eine gesunde Ernährung gegeben.
Begleiterkrankungen der Rheumatoiden Arthritis
Die RA hat insbesondere unbehandelt oder unzureichend therapiert zahlreiche Auswirkungen auf den generellen Gesundheitszustand des Organismus. Eine nicht oder unzureichend behandelte RA kann die Lebenserwartung um bis zu 10–15 Jahre verkürzen. Die Folge sind weitere Begleiterkrankungen (Komorbiditäten). So besteht beispielsweise bei Patient:innen mit RA und hoher Krankheitsaktivität ein erhöhtes Risiko für Tumoren des lymphatischen Systems (Lymphome) im Vergleich zur Normalbevölkerung. Darüber hinaus wissen wir auch, dass durch chronisch entzündliche Zustände das Risiko für Herz-Kreislauf-Erkrankungen, insbesondere für Herzinfarkte und Schlaganfälle, deutlich steigt. Daher sollten für Menschen, die an einer RA leiden, ein gesunder Lebensstil (ausreichende körperliche Aktivität, Nikotinverzicht usw.) und besonders die Ernährung einen hohen Stellenwert haben.
Zwei weitere wesentliche Komorbiditäten im Rahmen der RA, die auch mit zunehmendem Alter der Betroffenen einhergehen, sind die Osteoporose (Knochenschwund) und die Sarkopenie (Verlust an Muskelmasse). Beide Erkrankungen können eine wesentliche Bedrohung für Mobilität und Selbstständigkeit der Betroffenen darstellen.
Die Osteoporose
Die Osteoporose, auch als Knochenschwund oder Knochenbruchkrankheit bezeichnet, entsteht durch den Verlust an Knochenmasse sowie Veränderungen der Knochenarchitektur. Daraus resultiert eine abnehmende Knochenfestigkeit mit einem höheren Risiko für Brüche (Frakturen). Die Gründe dafür sind vielfältig.
Abbildung 2: Gesunder und osteoporotischer Knochen
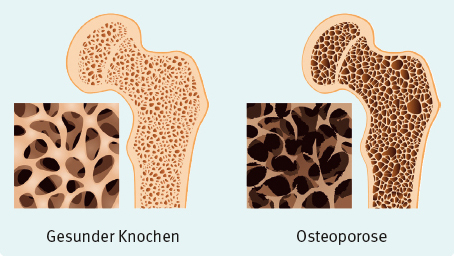
Ab dem 30.–40. Lebensjahr beginnen wir, langsam an Knochenmasse zu verlieren (0,5–1 % pro Jahr). Frauen sind in dieser Hinsicht besonders nach dem Wechsel gefährdet. Der Abfall des Östrogens ist dabei die Hauptursache, da dieses Hormon hemmend auf den Knochenabbau wirkt.
Früher wurde die Osteoporose nur durch die Knochenmineraldichte („Knochendichte“) definiert, die man mittels eines radiologischen Verfahrens, der Dualen Röntgen-Absorptionsdenistometrie (DXA; „Knochendichtemessung“), bestimmen kann. Dabei wird aber nur der Kalziumgehalt im Knochen erfasst. Heute wissen wir, dass auch viele andere Faktoren die Knochenfestigkeit und damit das Frakturrisiko bestimmen. So haben zwei Personen mit der gleichen Knochendichte je nach Alter ein völlig unterschiedliches Risiko, einen osteoporotischen Bruch zu erleiden. Tabelle 3 gibt einen Überblick über einige dieser zusätzlichen Risikofaktoren. Letztlich entscheidet der Arzt bzw. die Ärztin anhand der gemessenen Dichtewerte und der zusätzlichen Faktoren, ob eine spezifische Osteoporose-Therapie erforderlich ist.
Tabelle 3: Risikofaktoren für osteoporotische Frakturen
| Krankheiten mit erhöhtem Risiko
•Diabetes mellitus Typ I •Rheumatoide Arthritis •Spondylitis ankylosans (Morbus Bechterew) •Chronisch obstruktive Lungenerkrankung (COPD) •Primärer Hyperparathyreoidismus (Überfunktion der Nebenschilddrüse) •Hyperthyreoidismus (Überfunktion der Schilddrüse) •Bestehende Wirbelkörpereinbrüche •Zöliakie (Glutenunverträglichkeit) •Wiederholte Stürze •3 niedrigtraumatische Frakturen (Stürze aus geringer Höhe) in den letzten 10 Jahren •Hüftnahe Frakturen („Oberschenkelhals“-Bruch) bei einem Elternteil |
| Lebensstil
•Alkohol •Rauchen •Übergewicht •Untergewicht; Mangelernährung •Vitamin-D-Mangel(-Ernährung) •Immobilität |
| Medikamente
•Glukokortikoid („Cortison“)-Therapie (Prednisolon) •Inhalative Cortisontherapie •Protonenpumpeninhibitoren („Magenschutz“) •Antidepressiva •Antiepileptika •Hormonablative Therapie (z. B. bei Brustkrebs, Prostatakrebs) •Glitazone |
Der Knochenstoffwechsel
Das zusätzlich erhöhte Risiko für Osteoporose bei der RA ergibt sich aus dem Umstand, dass viele der oben erwähnten entzündungsfördernden Botenstoffe die sogenannten Osteoklasten aktivieren. Osteoklasten sind Zellen, die den Knochen abbauen. Wir wissen heute, dass die Zerstörung der Gelenke vor allem auch durch die Aktivierung der Osteoklasten verursacht wird. Aber natürlich führt dies auch generell zum vermehrten Abbau des Skelettknochens im Rahmen der RA. Durch den schubhaften Verlauf müssen viele Patient:innen immer wieder Corticosteroide („Cortison“) einnehmen, die wiederum die Entstehung der Osteoporose fördern. Es gibt selbstverständlich auch zahlreiche Medikamente zur Behandlung der Osteoporose, auf die einzugehen hier aber den Rahmen sprengen würde. Grundsätzlich gibt es Arzneien, die den Knochenabbau hemmen (antikatabole oder auch antiresorptive Wirkung), und Medikamente, welche die Knochenneubildung stimulieren (anabole Wirkung).
Das Skelett wird, ebenso wie viele andere Gewebe im Körper, während des Lebens ständig „renoviert“. Dabei wird kontinuierlich alter Knochen durch die sogenannten Osteoklasten abgebaut und neues Gewebe durch Osteoblasten gebildet. Das Grundgerüst des Knochens besteht aus Bindegewebe, das hauptsächlich Kollagen enthält. In dieser Form wäre der Knochen weich und biegsam, vergleichbar mit Gummi. Seine Festigkeit erhält der Knochen erst durch Einlagerung von Kalzium (in Form von Calcium-Phosphat). 99 % des gesamten Kalziums im menschlichen Körper sind in den Knochen und den Zähnen gebunden. Daher ist es wichtig, unseren Organismus ausreichend mit Kalzium zu versorgen, vorzugsweise über unsere Ernährung.
Für die Aufnahme des Kalziums aus der Nahrung und den Einbau in den Knochen benötigt der Körper auch ausreichend Vitamin D. Nur 10 % des Vitamin D, das wir benötigen, nehmen wir mit der Nahrung auf, 90 % werden in der Haut gebildet. Dafür ist aber die UV-Strahlung des Sonnenlichts erforderlich. In den Wintermonaten ist die Sonneneinstrahlung in unseren Breiten jedoch zu gering, damit die Haut ausreichend Vitamin D bilden kann. Daher sind wir gerade in den Jahreszeiten mit kürzeren Tagen (Herbst, Winter) gefährdet, einen Vitamin-D-Mangel zu entwickeln. Der richtige Speiseplan ist auch hier von zentraler Bedeutung. Und letztlich lässt sich der Knochen, ähnlich wie der Muskel, auch trainieren. Daher ist körperliche Aktivität unerlässlich.
Sarkopenie
Die Sarkopenie ist der altersbedingte Verlust an Muskelmasse. Dieser setzt etwa in der fünften Lebensdekade ein und nimmt mit fortschreitendem Alter zu. Verliert man zu Beginn ca. 8 % der Skelettmuskelmasse alle 10 Jahre, so verdoppelt sich dieser Verlust ab dem 70. Lebensjahr auf ca. 15 % pro Dekade. Ist ein gewisses Maß an Muskulatur unterschritten, treten rasch entsprechende Funktionseinbußen auf. Das Aufstehen aus einem Sessel ist nicht mehr möglich, die Bewältigung von wenigen Stufen wird zur großen Schwierigkeit, die Betroffenen verlieren rasch an Mobilität und sind im Falle von akuten Erkrankungen gefährdet, bettlägerig und damit pflegebedürftig zu werden.
Abbildung 3: Muskelstruktur bei Sarkopenie
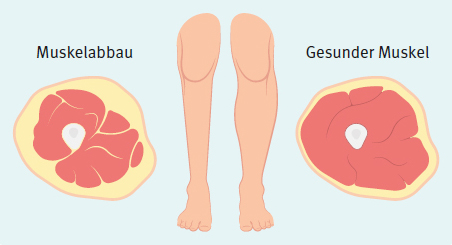
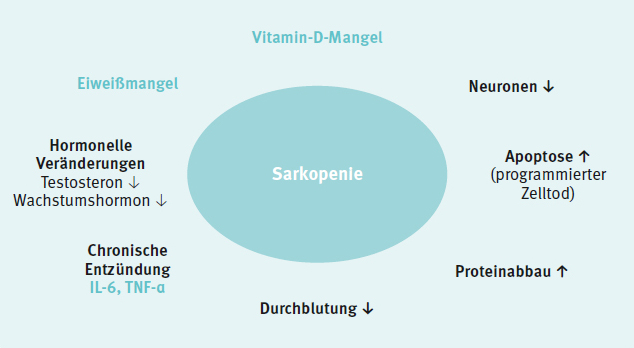
Die Ursachen der Sarkopenie sind vielfältig (Abbildung 1). Neben den verschiedenen Alterungsprozessen (Abbau von Nervenfasern, schlechtere Durchblutung u. a. m.) sind es vor allem chronisch entzündliche Zustände (insbesondere die bereits erwähnten proinflammatorischen Zytokine wie TNF-α, IL-6), Eiweißmangel und Vitamin-D-Mangel, welche bei der Entwicklung der Sarkopenie die Hauptfaktoren darstellen. Darin begründet sich auch das erhöhte Risiko für Menschen mit RA, sarkopen zu werden.
Abbildung 4: Ursachen der Sarkopenie
Trotz der vielen medikamentösen Möglichkeiten in der Medizin ist Krafttraining nach wie vor die einzige Therapiemöglichkeit, um der Sarkopenie vorzubeugen beziehungsweise sie zu behandeln. Dabei wird Krafttraining dreimal wöchentlich empfohlen, beginnend mit 40 % der Maximalkraft und sich langsam steigernd. Dieses sollte insbesondere zu Beginn unter professioneller Anleitung erfolgen. Ab dem 50. Lebensjahr bekommt Krafttraining in dieser Hinsicht einen höheren Stellenwert als Ausdauertraining. Aber auch Ausdauer ist wichtig für die Leistungsfähigkeit unseres Herz-Kreislauf-Systems und sollte daher nicht vergessen werden. In der Ernährung ist eine ausreichende Eiweißzufuhr unerlässlich, um den Muskelaufbau zu fördern. Die Empfehlungen für ältere Menschen liegen bei 1,2 g Eiweiß pro kg Körpergewicht und Tag. Eiweiß soll vor allem nach dem Training zugeführt werden, damit es besser für den Muskelaufbau verwertet werden kann.
Aus den oben erwähnten Aspekten zeigt sich die Bedeutung der qualitativen und quantitativen Zusammensetzung unserer Mahlzeiten. Daher ist nicht nur die Medizin, sondern auch unser Lebensstil für die Erhaltung unserer Gesundheit wichtig.
ERNÄHRUNG BEI RHEUMATOIDER ARTHRITIS
Eine Ernährungstherapie kann dabei unterstützen, Schmerzen zu lindern, längere schubfreie Intervalle zu erreichen und sogar bis zu einem gewissen Grad die benötigten Medikamente zu reduzieren.

Eine Dosisveränderung der Medikamente führen Sie bitte nie selbst durch! Wenden Sie sich an Ihren Arzt bzw. Ihre Ärztin!
Ziele einer Ernährungstherapie bei Rheumatoider Arthritis:
⇢entzündungsfördernde Faktoren vermindern
⇢entzündungshemmende Faktoren fördern
⇢Entzündungsreaktionen durch optimale Antioxidantien kontrollieren
⇢Osteoporoseprophylaxe
⇢Begleitende Nahrungsmittelunverträglichkeiten erkennen und behandeln
⇢Skelettmuskulatur erhalten, Mangelernährung vorbeugen
⇢Prävention von Arteriosklerose
Wichtig
Jegliche einseitige Diäten sind abzulehnen, da durch sie das Risiko, einen Nährstoffmangel zu entwickeln, erhöht ist.
Einflussnahme von Ernährung auf das Entzündungsgeschehen
Verhältnis der Fettsäuren
Eicosanoide sind Entzündungsmediatoren, also entzündungsfördernde Stoffe. Zu ihnen zählen Prostaglandine der Serie 2 und Leukotriene der Serie 4. Sie entstehen aus Arachidonsäure (AA), die zur Familie der mehrfach ungesättigten Omega-6-Fettsäuren gehört. Arachidonsäure kann unser Körper selbst aus Linolsäure bilden, die wir durch pflanzliche Lebensmittel aufnehmen, z. B. durch Distelöl, Maiskeimöl oder Kürbiskerne (siehe Tabellen 5 und 6). Die Umwandlungsrate ist jedoch relativ gering, darum bitte keine Scheu vor linolsäurereichen Lebensmitteln! Ausschlaggebend für die Bildung von entzündungsfördernden Stoffen ist vielmehr die direkte Zufuhr von Arachidonsäure, nämlich durch tierische Fette (siehe Tabelle 4).
Gegenspieler der Arachidonsäure sind die Eicosapentaensäure (EPA) und Docosahexaensäure (DHA) aus der Familie der mehrfach ungesättigten Omega-3-Fettsäuren. Diese hemmen auf verschiedenem Wege die entzündungsfördernden Faktoren. Einerseits dämmen sie die Umwandlung von Linolsäure zu Arachidonsäure ein, da beide (AA und EPA) das gleiche Enzym benötigen, um umgewandelt zu werden. Wenn viel α-Linolensäure vorhanden ist, tendiert das Enzym eher dazu, EPA herzustellen als AA. EPA und DHA werden nicht nur aus α-Linolensäure hergestellt, sondern können auch direkt über fettreiche Fische zugeführt werden.
Abbildung 5: Eicosanoidbildung (modifiziert nach Goldberg & Katz 2007)
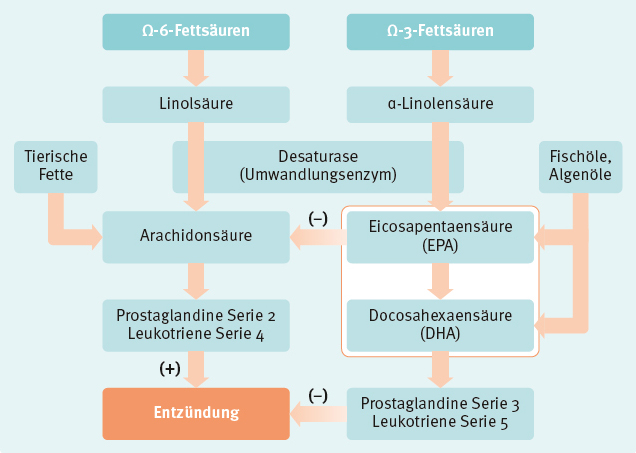
Der zweite entzündungshemmende Weg besteht darin, dass EPA und DHA selbst Ausgangsstoffe für entzündungshemmende Faktoren sind (Prostaglandine Serie 3 und Leukotriene Serie 5) und so Entzündungen direkt positiv beeinflussen.
Arachidonsäure reichert sich in den Zellmembranen an. Je mehr Arachidonsäure vorhanden ist, desto mehr entzündungsfördernde Substanzen werden daraus gebildet. Demnach sollten fettreiche tierische Lebensmittel gemieden werden. Bei Umstieg auf eine vegetarische Kost ist der positive Effekt natürlich noch größer.
Bonus
Indem Sie tierische Lebensmittel reduzieren und stattdessen mehr pflanzliche Nahrung in Ihren Essalltag einbauen, verkleinern Sie auch Ihren CO2-Abdruck – eine Wohltat für unseren Planeten!
Tabelle 4: Gehalt an Arachidonsäure in ausgewählten Lebensmitteln
| Lebensmittel | Arachidonsäure (mg pro 100 g Lebensmittel) |
| Schweineschmalz | 1700 mg |
| Schweineleber | 491 mg |
| Schweinespeck, durchwachsen | 250 mg |
| Brathuhn | 226 mg |
| Eigelb | 210 mg |
| Butter | 113 mg |
| Schweineschinken gekocht | 50 mg |
| Rindfleischfilet | 32 mg |
| Kuhmilch 3,6 % Fett | 4 mg |
Neben der Reduktion der Arachidonsäurezufuhr (max. 50 mg pro Tag) sollten im Gegensatz dazu vermehrt Omega-3-fettsäurereiche Lebensmittel eingebaut werden. Der Omega-3-Fettsäuregehalt alleine ist nicht ausschlaggebend, sondern vielmehr das Verhältnis von Omega-6 zu Omega-3. Dieses Verhältnis sollte laut den D-A-C-H-Referenzwerten 5:1 nicht überschreiten. Die tatsächliche Zufuhr in der gesunden, erwachsenen österreichischen Bevölkerung liegt jedoch weit darüber. Die fett markierten Lebensmittel in der folgenden Tabelle heben jene Öle hervor, die zu bevorzugen sind. Für die warme Küche eignet sich zum Braten somit raffiniertes Rapsöl am besten. Tierische Fette und auch Kokosöl fördern aufgrund ihrer Fettsäurezusammensetzung den Entzündungsprozess und sind deshalb ungeeignet. Für die kalte Küche, wie Salate oder auch Porridge, eignen sich am besten Leindotteröl, Leinöl, Hanföl und Walnussöl.
Tabelle 5: Fettsäuremuster von ausgewählten Ölen und Streichfetten
| 100 g Lebensmittel | Omega-6-Fettsäuren (größtenteils Linolsäure) | Omega-3-Fettsäuren (größtenteils Linolensäure) |
| Leindotteröl | 18 mg | 37 mg |
| Leinöl | 14,7 mg | 58 mg |
| Distelöl | 76,7 mg | 0,3 mg |
| Hanföl | 58 mg | 16 mg |
| Rapsöl | 19 mg | 8 mg |
| Sojaöl | 52,9 mg | 7,7 mg |
| Olivenöl | 9 mg | 1 mg |
| Walnussöl | 61,1 mg | 13 mg |
| Sonnenblumenöl | 63 mg | 0,2 mg |
| Maiskeimöl | 55,5 mg | 0,9 mg |
| Distelöl | 76,7 mg | 0,3 mg |
| Kürbiskernöl | 49 mg | 0,2 mg |
| Feste Fette | ||
| Butter | 1,2 mg | 0,5 mg |
| Margarine | 17,1 mg | 2,6 mg |
| Kokosöl | 1,7 mg | 0 mg |
| Schmalz | 11 mg | 1 mg |
Auch Nüsse, Samen und Kerne sind wertvolle Fettträger. Die fett markierten Lebensmittel in der folgenden Tabelle sind zu bevorzugen, da sie ein optimales Verhältnis von Omega-6 zu Omega-3 aufweisen. Salaten, Suppen, Desserts, Porridge oder belegten Broten können mit Walnüssen, Hanfsamen, Leinsamen oder Chiasamen Omega-3-Boosts verschafft werden.

Tipp
Chia- und Leinsamen sind von der Zusammensetzung her sehr ähnlich. Der Unterschied: Chiasamen werden aus Mittel- und Südamerika importiert, Leinsamen sind auch bei uns in Mitteleuropa heimisch. Um unseren Planeten nicht zu sehr zu belasten, setzen Sie deshalb lieber auf die regionalen Leinsamen.
Tabelle 6: Fettsäuremuster von ausgewählten Nüssen, Samen und Kernen
| 100 g Lebensmittel | Omega-6-Fettsäuren (größtenteils Linolsäure) |
Omega-3-Fettsäuren (größtenteils Linolensäure) |
| Walnüsse | 42 mg | 10,2 mg |
| Hanfsamen | 19 mg | 3,1 mg |
| Leinsamen | 5,4 mg | 20,2 mg |
| Chiasamen | 5,7 mg | 18,5 mg |
| Haselnüsse | 6,4 mg | 0,1 mg |
| Mandeln | 11,5 mg | 0 mg |
| Erdnüsse | 13,8 mg | 0,5 mg |
| Kürbiskerne | 18,9 mg | 0 mg |
| Sonnenblumenkerne | 16,7 mg | 0,03 mg |
Die wertvollen Omega-3-Fettsäuren EPA und DHA können wir in nennenswerten Mengen nur durch fettreichen Fisch und Mikroalgen zu uns nehmen. Nach den D-A-C-H-Empfehlungen sollten wir zweimal pro Woche Fisch essen. Auch hier können wir auf mehr Nachhaltigkeit achten. Unsere Ozeane sind bereits überfischt und das Ökosystem dadurch bedroht. Die Herstellung von Mikroalgenölen benötigt viel Energie und Wasser, schont jedoch den Fischbestand.
Die Supplementierung von EPA und DHA zur Linderung von Schmerzen und Reduktion des Medikamentenbedarfs bei Rheumatoider Arthritis ist wissenschaftlich gesichert. Eine Reduktion der Zufuhr an Arachidonsäure (max. 50 mg pro Tag), gemeinsam mit der Einnahme von EPA- und DHA-Supplementen, stellte sich als wirksam heraus. Eine Besserung der Symptome kann nach 3 Monaten erwartet werden.
Tabelle 7: Fettsäuremuster von Fischen
| 100 g Lebensmittel | Omega-6-Fettsäuren (größtenteils Linolsäure) |
Omega-3-Fettsäuren (größtenteils EPA + DHA) |
| Lachs | 886 mg | 300 mg |
| Hering | 153 mg | 62 mg |
| Makrele, gegart | 186 mg | 273 mg |
| Forelle, gegart | 269 mg | 48 mg |
| Kabeljau | 15 mg | 4 mg |
| Aal, geräuchert | 1436 mg | 770 mg |
Was heißt das nun für Ihre Ernährung im Alltag?
•Reduktion fettreicher, tierischer Lebensmittel, da sie reich an Arachidonsäure sind (= entzündungsfördernd): so wenig Fleisch und Fleischprodukte wie möglich – am besten vegetarische Kost
•Lebensmittel, die reich an Omega-3-Fettsäuren sind, einbauen: Walnüsse und -öl, Leinsamen und -öl, Hanfsamen und -öl, Rapsöl
•zweimal pro Woche Fisch einplanen (z. B. Lachs, Hering, Makrele) oder Fischöl- bzw. Algenölsupplemente einnehmen, jedoch nur mit ärztlicher Verordnung. Für die optimale Dosierung wenden Sie sich am besten an eine:n Diätolog:in und Ihre:n Arzt/Ärztin.
Entzündungsreaktionen durch optimale Antioxidantien kontrollieren
Freie Radikale & Antioxidantien
Als freie Radikale werden Atome, Moleküle oder Ionen mit einem oder mehreren ungepaarten Elektronen verstanden. Sie können Entzündungsreaktionen aktivieren und zu Zellschäden bis hin zur Tumorentstehung führen. Freie Radikale können durch körpereigene Vorgänge oder durch exogene Faktoren, wie z. B. Zigarettenrauch, entstehen. Sie sind per se nicht schädlich, wenn ein ausgewogenes Verhältnis zwischen Faktoren, die die Entstehung von freien Radikalen begünstigen, und antioxidativen Schutzmechanismen besteht. Zu den Antioxidantien gehören bestimmte Enzyme, Vitamine, sekundäre Pflanzenstoffe und indirekt auch Mineralstoffe. Die bedeutendsten Antioxidantien in unserer Nahrung sind: Vitamin E, Vitamin C, Vitamin A bzw. die Vorstufe β-Carotin. Selen und Zink wirken indirekt als Antioxidantien, da sie Bestandteile von wichtigen Enzymen sind, die freie Radikale unschädlich machen.
Abbildung 6: Begünstigende Faktoren zur Bildung freier Radikale (modifiziert nach Kasper & Burghart, 2014)

Die Entzündungskaskade bei Rheumatoider Arthritis wird nicht nur durch die aufgenommene Arachidonsäure angestoßen, sondern auch durch freie Radikale. Durch deren Einfluss entstehen Lipidperoxide, die ein Enzym aktivieren, das Arachidonsäure aus den Zellen freisetzt.
Mit der antioxidativen Abwehr können freie Radikale unschädlich gemacht werden. Dies funktioniert wie folgt: Elektronen müssen immer als Paar auftreten. Da freie Radikale ungepaarte Elektronen aufweisen, werden sie unschädlich gemacht, indem ein Antioxidans (Vitamin E) dem freien Radikal das fehlende Elektron abgibt. Dadurch wird das Antioxidans selbst zum freien Radikal. Nun kommt ein weiteres Antioxidans (Vitamin C) und gibt dem neu entstandenen Radikal ein Elektron ab, um es unschädlich zu machen. Dieser Prozess setzt sich mithilfe von verschiedenen Enzymen so lange fort, bis das freie Radikal abgebaut und unschädlich gemacht wurde.
Vitamin A und β-Carotin

Retinol ist die wichtigste Vitamin-A-Verbindung für den Körper. Wir müssen es mit der Nahrung zuführen, da es unser Körper nicht selbst herstellen kann. In der Leber wird es gespeichert. Die bekannteste Wirkung von Vitamin A ist wohl, dass es für die Augengesundheit bzw. für den Sehvorgang wichtig ist. β-Carotin als Provitamin A (Vorstufe von Vitamin A) fungiert hingegen als Antioxidans.
Vitamin A kommt in allen tierischen Lebensmitteln vor: Milch, Eier, Fisch. Die höchste Vitamin-A-Konzentration findet sich in der Leber. Einzig durch den Konsum von Leber kann man eine Überdosierung des Vitamins über die Ernährung herbeiführen. Schwangere sollten deshalb besonders im 1. Trimester auf Leber verzichten.
β-Carotin können wir nur aus pflanzlichen Lebensmitteln aufnehmen. Es handelt sich dabei um den gelben und orangen Farbstoff in Obst und Gemüse. Aber auch in manchen grünen Gemüsesorten findet sich β-Carotin. Hier wird die typische Färbung durch das grüne Chlorophyll überlagert. Interessant ist, dass der verwertbare Carotingehalt in erhitzten Lebensmitteln höher ist. So kann der Körper aus Karottensuppe mehr β-Carotin aufnehmen als aus rohen Karotten.
Tabelle 8: β-Carotin-Quellen
| Karotten | Spinat |
| Mango | Brokkoli |
| Aprikosen/Marillen | Kohl |
β-Carotin kann in der Leber nur mit Hilfe von Fett zu Vitamin A umgewandelt werden. Ein Teelöffel Öl über dem Salat kann somit die Umwandlung steigern.
Der Tagesbedarf von 2–4 mg β-Carotin bei Erwachsenen kann über die Ernährung durch 200–250 g tiefgrünes und orangefarbenes Gemüse und Obst gedeckt werden.
Vitamin E

Unter Vitamin E werden unterschiedliche Verbindungen von Tocopherolen verstanden. Die aktivste Form im Körper ist das α-Tocopherol. Es ist ein fettlösliches Vitamin – das bedeutet, dass es nur in Verbindung mit Fett im Körper aufgenommen und verwertet wird. Wie alle Vitamine kann unser Körper auch Vitamin E nicht selbst herstellen, es gilt somit als essenziell – wir müssen es mit der Nahrung zuführen. Es wird in der Leber und im Fettgewebe gespeichert. Die wichtigste Funktion von Vitamin E ist der Schutz von mehrfach ungesättigten Fettsäuren (z. B. Omega-3-Fettsäuren) und Vitamin A vor der Oxidation. Das bedeutet auch, dass mehr Vitamin E verbraucht wird, je mehr mehrfach ungesättigte Fettsäuren man zu sich nimmt. Diese antioxidative Wirkung wird jedoch nicht dem α-Tocopherol, sondern dem γ-Tocopherol zugeschrieben.
Vitamin E kommt hauptsächlich in Pflanzenkeimen und Ölsaaten vor. Die daraus hergestellten Öle stellen für uns eine nützliche Vitamin-E-Quelle dar.
Tabelle 9: Vitamin-E-Quellen
| Lebensmittel | Tocopherol-Verbindung |
| Weizenkeimöl | α-Tocopherol |
| Sonnenblumenöl | α-Tocopherol |
| Olivenöl | α-Tocopherol |
| Maiskeimöl | α-Tocopherol, γ-Tocopherol |
| Sojaöl | γ-Tocopherol |
| Leinsamenöl | γ-Tocopherol |
| Rapsöl | γ-Tocopherol |
Auch in Gemüse kommt Vitamin E vor, jedoch in viel geringeren Mengen. Den Tagesbedarf von 80 mg TocopherolÄquivalenten bei Männern und 65 mg bei Frauen könnte man zum Beispiel mit ca. 40 g (ca. 4 EL) Rapsöl oder 6 g Weizenkeimöl (ca. 2 TL) decken.
Vitamin C

Vitamin C, auch Ascorbinsäure genannt, ist wohl das bekannteste Vitamin. Es ist bei zahlreichen Stoffwechselvorgängen im Körper beteiligt, z. B. Kollagenbildung, Wundheilung, Immunsystem oder Verbesserung der Eisenaufnahme. Als Antioxidans schützt es vor entzündlichen Prozessen. Als wasserlösliches Vitamin kann es im Körper nicht gespeichert werden. Die Aufnahmekapazitäten sind ebenso begrenzt. Das bedeutet, je mehr Vitamin C auf einmal zugeführt wird, desto weniger kann davon aufgenommen werden. Überschüssige Mengen werden über die Nieren ausgeschieden. Deshalb erfolgt die Vitamin-C-Zufuhr am besten über den Tag verteilt in kleineren Mengen.
Details
- Seiten
- 152
- ISBN (ePUB)
- 9783991115199
- Sprache
- Deutsch
- Erscheinungsdatum
- 2022 (Mai)
- Schlagworte
- Böhm chronisch entzündliche Erkrankungen Bewegungseinschränkung Nahrungsmittelunverträglichkeiten Muskelabbau Schmerz Polyarthritis Arthritis Köller Gelenksentzündung Rheumatoide

